Veraflox 120 Mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Veraflox 15 mg tablety pro psy a kočky Veraflox 60 mg tablety pro psy Veraflox 120 mg tablety pro psy
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Každá tableta obsahuje:
Léčivá látka:
Pradofloxacinum 15 mg
Pradofloxacinum 60 mg
Pradofloxacinum 120 mg
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tablety
Nahnědlé tablety s půlící rýhou a s „P15“na jedné straně
Nahnědlé tablety s půlící rýhou a s „P60“na jedné straně
Nahnědlé tablety na s půlící rýhou a s „P120“jedné straně
Tabletu lze rozdělit na stejné dávky.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi, kočky
4.2 Indikace s upřesněním pro cílový druh zvířat
Psi:
Léčba:
• infekcí ran vyvolaných citlivými kmeny skupiny Staphylococcus intermedius (včetně
S. pseudintermedius),
• povrchových a hlubokých pyodermií vyvolaných citlivými kmeny skupiny Staphylococcus intermedius (včetně S. pseudintermedius),
• akutních infekcí močového traktu vyvolaných citlivými kmeny Escherichia coli a skupiny Staphylococcus intermedius (včetně S. pseudintermedius) a
• jako terapie doplňující mechanické čištění nebo chirurgickou periodontální léčbu těžkých infekcí dásní a periodontálních tkání vyvolaných citlivými kmeny anaerobních bakterií například Porphyromonas spp. a Prevotella spp. (viz část 4.5).
Kočky:
Léčba akutních infekcí horních cest dýchacích vyvolaných citlivými kmeny Pasteurella multocida, Escherichia coli a skupiny Staphylococcus intermedius (včetně S. pseudintermedius).
4.3 Kontraindikace
Nepoužívat u zvířat se známou přecitlivělostí na fluorochinolony.
Psi:
Nepoužívat u psů během období růstu, protože by mohlo dojít k poškození kloubních chrupavek. Období růstu psů závisí na plemeni; pro většinu plemen platí, že se nesmí používat veterinární léčivé přípravky obsahující pradofloxacin u psů mladších 12 měsíců, u obrovských plemen se použití nedoporučuje do stáří 18 měsíců.
Nepoužívat u psů s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívat u psů s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u psů během březosti a laktace (viz část 4.7).
Kočky:
Pro absenci dostupných informací se nedoporučuje podávat pradofloxacin u koťat mladších 6 týdnů.
Pradofloxacin nepoškozuje vývoj chrupavek u koťat ve věku 6 týdnů a starších. Avšak přípravek nesmí být použit pro kočky s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívat u koček s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u koček během březosti a laktace (viz část 4.7).
4.4 Zvláštní upozornění pro každý cílový druh
Nejsou.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Pokud je to možné, veterinární léčivý přípravek by měl být používán pouze na základě výsledků testů citlivosti.
Při podávání veterinárního léčivého přípravku je nutno zohlednit oficiální a místní antimikrobiální politiku.
Je vhodné využívat fluorochinolony pouze pro léčbu klinických onemocnění, které špatně odpovídají nebo u kterých se předpokládá, že budou špatně reagovat na léčbu jinou skupinou antibiotik.
Použití veterinárního léčivého přípravku v rozporu s pokyny uvedenými v souhrnu údajů o přípravku (SPC) může zvýšit počet bakterií rezistentních na fluorochinolony a také snížit účinnost terapie ostatními fluorochinolony v důsledku zkřížené rezistence.
Pyodermie vznikají většinou sekundárně následkem primárního onemocnění, a proto se doporučuje diagnostikovat primární příčinu zdravotní poruchy a zaměřit se na její léčbu.
Tento veterinární léčivý přípravek by měl být použit pouze ve vážných případech periodontálních onemocnění. Základem dlouhodobé úspěšné léčby je mechanické vyčištění zubů a odstranění zubního plaku a kamene nebo extrakce zubů. V případě gingivitidy nebo periodontitidy lze využít veterinární léčivý přípravek pouze jako doplněk k mechanickému čištění nebo chirurgické léčbě periodontu.
Tento veterinární přípravek by měl být podáván jen psům, u nichž nelze dosáhnout vyléčení pouze mechanickým čištěním.
Pradofloxacin může zvýšit citlivost kůže na sluneční záření. Během terapie by proto zvířata neměla být vystavena nadměrnému slunečnímu záření.
Vylučování ledvinami je důležitá cesta eliminace pradofloxacinu u psů. Stejně jako u ostatních fluorochinolonů, renální exkrece pradofloxacinu může být zpomalena u psů s poškozenou funkcí ledvin, a proto by měl být pradofloxacin u takových zvířat použit jen po pečlivém zvážení.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Vzhledem k možnému škodlivému účinku, musí být tablety udržovány mimo dosah dětí.
Lidé se známou přecitlivělostí na chinolony by se měli vyvarovat kontaktu s tímto veterinárním léčivým přípravkem.
Zamezte kontaktu veterinárního léčivého přípravku s kůží nebo očima. Umyjte si řádně ruce po použití přípravku.
Nejezte, nepijte a nekuřte při manipulaci s veterinárním léčivým přípravkem.
V případě náhodného požití vyhledejte lékařskou pomoc a příbalovou informaci nebo etiketu produktu ukažte praktickému lékaři.
4.6 Nežádoucí účinky (frekvence a závažnost)
Ve vzácných případech byly u psů a koček pozorovány mírné přechodné trávicí poruchy včetně zvracení.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Bezpečnost tohoto veterinárního léčivého přípravku během březosti a laktace u koček a psů nebyla stanovena.
Březost:
Nepoužívat během březosti. Pradofloxacin způsobil oční malformace při podávání potkanům ve fetálních a maternálních toxických dávkách.
Laktace:
Nepoužívat během laktace. Laboratorní studie u štěňat prokázaly vznik artropatií po systémovém podávání fluorochinolonů. Je známo, že fluorochinolony přestupují přes placentu a dostávají se do mléka.
Plodnost:
Bylo prokázáno, že pradofloxacin nemá žádný účinek na plodnost u chovných zvířat.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Byl zaznamenán pokles biologické dostupnosti fluorochinolonů při souběžném podávání s kationty kovů obsaženými např. v antacidech nebo sukralfátu, pokud jsou tyto přípravky vyrobeny na bázi hydroxidu hořečnatého nebo hydroxidu hlinitého, či s multivitaminy obsahujícími železo nebo zinek, nebo mléčnými výrobky s obsahem vápníku. Proto by Veraflox neměl být podáván společně s antacidy, sukralfátem, multivitaminy nebo mléčnými výrobky, protože může dojít k poklesu absorpce Verafloxu. Dále by fluorochinolony neměly být podávány v kombinaci s nesteroidními antiflogistiky (NSAIDs) zvířatům trpícím záchvaty z důvodu možných farmakodynamických interakcí v CNS. Kombinace fluorochinolonů s teofylinem může zvýšit plazmatické hladiny theofylinu z důvodu změny metabolismu theofylinu. Proto by se mělo zabránit této kombinaci. Zároveň se doporučuje vyvarovat souběžnému podávání fluorochinolonů s digoxinem z důvodu možného zvýšení biologické perorální dostupnosti dioxinu.
4.9 Podávané množství a způsob podání
Perorální podání
Dávkování
Doporučená dávka je 3 mg pradofloxacinu/kg živé hmotnosti jedenkrát denně. Z důvodu dostupných velikostí tablet je výsledná dávka v rozmezí 3 mg až 4,5 mg/ kg ž. hm. podle následujících tabulek.
K určení správné dávky je nutno pacienta co nejpřesněji zvážit, aby se předešlo poddávkování. Pokud dávkování vyžaduje podání jen poloviny tablety, zbývající část tablety má být použita při příštím podání.
Psi:
|
Živá hmotnost psů (kg) |
Počet tablet |
Dávka pradofloxacinu | ||
|
15 mg |
60 mg |
120 mg |
(mg/kg ž.hm.) | |
|
>3,4 - 5 |
1 |
3- 4,4 | ||
|
5 - 7,5 |
1/ |
3 - 4,5 | ||
|
7,5 - 10 |
2 |
3 - 4 | ||
|
10 - 15 |
3 |
3 - 4,5 | ||
|
15 - 20 |
1 |
3 - 4 | ||
|
20 - 30 |
1/ |
3 - 4,5 | ||
|
30 - 40 |
1 |
3 - 4 | ||
|
40 - 60 |
1/ |
3 - 4,5 | ||
|
60 - 80 |
2 |
3 - 4 | ||
Kočky:
|
Živá hmotnost koček (kg) |
Počet tablet |
Dávka pradofloxacinu (mg/kg ž.hm.) |
|
15 mg | ||
|
>3,4 - 5 |
1 |
3 - 4,4 |
|
5 - 7,5 |
1/ |
3 - 4,5 |
|
7,5 - 10 |
2 |
3 - 4 |
Doba léčby
Délka terapie závisí na povaze a závažnosti infekce a na úspěšnosti léčby. Pro většinu infekcí jsou následující doby léčby dostačující:
Psi:
|
Indikace |
Délka terapie (dny) |
|
Infekce kůže: | |
|
Superficiální pyodermie |
14 - 21 |
|
Hluboká pyodermie |
14 - 35 |
|
Infekce ran |
7 |
|
Akutní infekce močového traktu |
7 - 21 |
|
Těžké infekce dásní a periodontálních tkání |
7 |
Léčba by měla být znovu posouzena, pokud není pozorováno zlepšení klinického stavu 3 dny od zahájení léčby, v případech povrchové pyodermie po 7 dnech a v případech hluboké pyodermie po 14 dnech od zahájení léčby.
Kočky:
|
Indikace |
Délka terapie (dny) |
|
Akutní infekce horních cest dýchacích |
5 |
Léčba by měla být znovu posouzena, pokud není pozorováno zlepšení stavu 3 dny od zahájení léčby.
4.10 Předávkování (symptomy, první pomoc, antidota)
Nejsou známa specifická antidota pradofloxacinu (nebo jiných fluorochinolonů), proto by v případě předávkování měla být podávána symptomatická léčba.
Bylo pozorováno občasné zvracení a měkká stolice u psů po opakovaném perorálním podávání 2,7 násobku maximální doporučené dávky.
Zřídka bylo pozorováno zvracení u koček po opakovaném perorálním podávání 2,7 násobku maximální doporučené dávky.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Antibakteriální látky pro systémové použití, fluorochinolony.
ATCvet kód: QJ01MA97
5.1 Farmakodynamické vlastnosti
Způsob účinku
Primární způsob účinku fluorochinolonů spočívá v interakci s enzymy nezbytnými pro hlavní funkce DNA, jako jsou replikace, transkripce a rekombinace. Primárními cíli pro pradofloxacin jsou bakteriální enzymy DNA gyrázy a topoisomerázy IV. Reversibilní spojení mezi pradofloxacinem a DNA gyrázou nebo DNA topoisomerázou IV v cílové baktérii vede k inhibici těchto enzymů a k rychlé smrti bakteriální buňky. Rychlost a rozsah smrtícího účinku na bakterie jsou v přímé úměře ke koncentraci léčiva.
Antibakteriální spektrum
Ačkoliv má pradofloxacin účinek in-vitro na široké spektrum grampozitivních a gramnegativních organismů, včetně anaerobních bakterií, tento veterinární léčivý přípravek by měl být použit pouze na schválené indikace (viz bod 4.2) a v souladu s upozorněním o indikačním omezení v bodě 4.5 tohoto SPC.
Údaje o MIC Psi:
|
Bakteriální druhy |
Počet kmenů |
MIC50 (ág/ml) |
MIC90 (ág/ml) |
Rozmezí MIC (ág/ml) |
|
Skupina Staphylococcus intermedius (Včetně S. pseudintermedius) |
1097 |
0,062 |
0,062 |
0,002-4 |
|
Escherichia coli |
173 |
0,031 |
0,062 |
0,008-16 |
|
Porphyromonas spp. |
310 |
0,062 |
0,125 |
< 0,016-0.5 |
|
Prevotella spp. |
320 |
0,062 |
0,25 |
< 0,016-1 |
Jedná se o bakteriální izoláty získané mezi lety 2001 až 2007 z klinických případů v Belgii, Francii, Německu, Maďarsku, Itálii, Polsku, Švédsku a Velké Británii.
Kočky:
|
Bakteriální druhy |
Počet kmenů |
MIC50 (ág/ml) |
MIC90 (ág/ml) |
Rozmezí MIC (ág/ml) |
|
Pasteurella multocida |
323 |
0,016 |
0,016 |
0,002-0,062 |
|
Escherichia coli |
135 |
0,016 |
4 |
0,008-8 |
|
Skupina Staphylococcus intermedius (včetně S. pseudintermedius) |
184 |
0,062 |
0,125 |
0,016-8 |
Jedná se o bakteriální izoláty získané mezi lety 2001 až 2007 z klinických případů v Belgii, Francii, Německu, Maďarsku, Itálii, Polsku, Švédsku a Velké Británii.
Druhy a mechanismy vzniku rezistence
Podle studií vzniká rezistence na fluorochinolony z pěti příčin, (i) bodové mutace genů kódujících DNA gyrázu a/nebo topoisomerázu IV, jež způsobují změny těchto enzymů, (ii) změny permeability přípravku gramnegativními bakteriemi, (iii) mechanismus efluxu, (iv) rezistence zprostředkovaná plazmidy a (v) proteiny chránící gyrázu. Všechny tyto mechanismy vyvolávají sníženou citlivost bakterií na fluorochinolony. Častá je také zkřížená rezistence v rámci třídy fluorochinolonů.
5.2 Farmakokinetické údaje
Laboratorní studie ukázaly, že u nakrmených psů a koček byla snížena biologická dostupnost pradofloxacinu v porovnání s lačnými zvířaty. Nicméně klinické studie neodhalily žádný vliv krmení na efekt léčby.
Psi:
Po perorální aplikaci terapeutické dávky u psů je pradofloxacin rychle (Tmax 2 hodiny) a téměř kompletně (přibližně 100%) absorbován a dosahuje maximální koncentrace 1,6 mg/l.
U psů je pozorován lineární vztah mezi sérovou koncentrací pradofloxacinu a podanou dávkou při dávkách testovaných v rozmezí 1 až 9 mg/kg živé hmotnosti. Dlouhodobé denní podávání nemá žádný vliv na farmakokinetický profil, při akumulačním indexu 1,1. Vazba na plazmatické proteiny in vitro je nízká (35%). Velký distribuční objem (Vd) >2 l/kg živé hmotnosti je známkou dobré tkáňové prostupnosti. Koncentrace pradofloxacinu v homogenátu kůže psů překročila sérovou koncentraci až sedminásobně.
Pradofloxacin je eliminován ze séra s konečným biologickým poločasem 7 hodin. Hlavní cesty vylučování jsou glukuronidace a exkrece ledvinami. Clearence pradofloxacinu z těla je 0,24 l/h/kg. Přibližně 40% aplikovaného léčiva je vyloučeno ledvinami v nezměněné formě.
Kočky:
U koček je absorpce po perorálním podání pradofloxacinu v terapeutické dávce rychlá, s dosažením maximální koncentrace 1,2 mg/l během 0,5 hodiny. Biologická dostupnost tablet je minimálně 70%. Opakované dávkování nemá žádný dopad na farmakokinetický profil (akumulační index = 1,0). Vazba na plazmatické proteiny in vitro je nízká (30%). Velký distribuční objem (Vd) >4 l/kg živé hmotnosti je známkou dobré tkáňové prostupnosti.
Pradofloxacin je eliminován ze séra s konečným biologickým poločasem 9 hodin. Hlavní cesta vylučování u koček je glukuronidace. Clearence pradofloxacinu z těla je 0,28 l/h/kg.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát laktózy Mikrokrystalická celulóza Povidon
Magnesium-stearát Koloidní bezvodý oxid křemičitý Umělé hovězí aroma Sodná sůl kroskarmelosy
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
Doba použitelnost veterinárního léčivého přípravku v neporušeném obalu: 3 roky
6.4 Zvláštní opatření pro uchovávání
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
6.5 Druh a složení vnitřního obalu
Papírové krabičky s aluminiovými blistry. Jeden blistr obsahuje 7 tablet.
K dostání jsou následující balení:
7 tablet 21 tablet 70 tablet
140 tablet
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
8. REGISTRAČNÍ ČÍSLO
EU/2/10/107/001-012
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 12/04/2011
Datum posledního prodloužení: DD/MM/RRRR
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
Veraflox 25 mg/ml perorální suspenze pro kočky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Každý ml obsahuje:
Léčivá látka:
Pradofloxacinum 25 mg
Pomocné látky:
Konzervační látka: kyselina sorbová (E200) 2 mg
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Perorální suspenze.
Žlutavá až béžová suspense.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Kočky
4.2 Indikace s upřesněním pro cílový druh zvířat
Léčba:
• akutních infekcí horních cest dýchacích vyvolaných citlivými kmeny Pasteurella multocida, Escherichia coli a skupiny Staphylococcus intermedius (Včetně S. pseudintermedius).
• infekcí ran a abscesů vyvolaných citlivými kmeny Pasteurella multocida a skupiny Staphylococcus intermedius (včetně S. pseudintermedius).
4.3 Kontraindikace
Nepoužívejte u koček se známou přecitlivělostí na fluorochinolony.
Pro absenci dostupných informací se nedoporučuje podávat pradofloxacin u koťat mladších 6 týdnů.
Pradofloxacin nepoškozuje vývoj chrupavek u koťat ve věku 6 týdnů a starších. Avšak přípravek nesmí být použit pro kočky s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívat u koček s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u koček během březosti a laktace (viz část 4.7).
4.4 Zvláštní upozornění pro každý cílový druh
Nejsou.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Pokud je to možné, tento veterinární léčivý přípravek by měl být používán pouze na základě výsledků testů citlivosti.
Při podávání veterinárního léčivého přípravku je nutno zohlednit oficiální a místní antimikrobiální politiku.
Je vhodné využívat fluorochinolony pouze pro léčbu klinických onemocnění, které špatně odpovídají nebo u kterých se předpokládá, že budou špatně reagovat na léčbu jinými třídami antibiotik.
Použití veterinárního léčivého přípravku v rozporu s pokyny uvedenými v SPC může zvýšit počet bakterií rezistentních na fluorochinolony a také snížit účinnost terapie ostatními fluorochinolony v důsledku zkřížené rezistence.
Pradofloxacin může zvýšit citlivost kůže na sluneční záření. Během terapie by proto zvířata neměla být vystavena nadměrnému slunečnímu záření.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Vzhledem k možnému škodlivému účinku, musí být lahvičky a naplněné stříkačky udržovány mimo dosah dětí.
Lidé se známou přecitlivělostí na chinolony by se měli vyvarovat kontaktu s tímto veterinárním léčivým přípravkem.
Zamezte kontaktu veterinárního léčivého přípravku s kůží nebo očima. Umyjte si řádně ruce po použití přípravku.
V případě náhodného zasažení očí je okamžitě vypláchněte vodou.
V případě kontaktu s kůží, opláchněte vodou.
Nejezte, nepijte a nekuřte při manipulaci s veterinárním léčivým přípravkem.
V případě náhodného požití vyhledejte lékařskou pomoc a příbalovou informaci nebo etiketu produktu ukažte praktickému lékaři.
4.6 Nežádoucí účinky (frekvence a závažnost)
Ve vzácných případech byly pozorovány mírné a přechodné trávící poruchy včetně zvracení.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Bezpečnost tohoto veterinárního léčivého přípravku během březosti a laktace nebyla u koček stanovena.
Březost:
Nepoužívat během březosti. Pradofloxacin způsobil oční malformace při podávání potkanům ve fetálních a maternálních toxických dávkách.
Laktace:
Nepoužívat během laktace, protože nejsou k dispozici žádné údaje o použití pradofloxacinu u koťat mladších 6 měsíců. Je známo, že fluorochinolony přestupují přes placentu a dostávají se do mléka.
Plodnost:
Bylo prokázáno, že pradofloxacin nemá žádný účinek na plodnost u chovných zvířat.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Byl zaznamenán pokles biologické dostupnosti fluorochinolonů při souběžném podávání s kationty kovů obsaženými např. v antacidech nebo sukralfátu s obsahem hydroxidu hořečnatého nebo hydroxidu hlinitého, či s multivitaminy obsahujícími železo nebo zinek, nebo mléčnými výrobky s obsahem vápníku. Proto by Veraflox neměl být podáván společně s antacidy, sukralfátem, multivitaminy nebo mléčnými výrobky, jelikož může dojít k poklesu absorpce Verafloxu.
Dále by fluorochinolony neměly být podávány v kombinaci s nesteroidními antiflogistiky (NSAIDs) zvířatům trpícím záchvaty z důvodu možných farmakodynamických interakcí v CNS. Kombinace fluorochinolonů s teophylinem může zvýšit plazmatické hladiny theofylinu z důvodu změny metabolismu theofylinu. Proto by se mělo zabránit této kombinaci. Zároveň se doporučuje vyvarovat souběžnému podávání fluorochinolonů s digoxinem z důvodu možného zvýšení biologické perorální dostupnosti digoxinu.
4.9 Podávané množství a způsob podání
Perorální aplikace.
Dávkování
Doporučená dávka je 5mg pradofloxacinu/kg živé hmotnosti jedenkrát denně. Vzhledem k stupnici na stříkačce je výsledné dávkování v rozmezí 5 mg až 7,5 mg/ kg ž. hm podle následující tabulky:
|
Živá hmotnost koček (kg) |
Dávka perorální suspenze k aplikaci (ml) |
Dávka pradofloxacinu (mg/kg ž.hm.) |
|
> 0,67 - 1 |
0,2 |
5 - 7,5 |
|
1 - 1,5 |
0,3 |
5 - 7,5 |
|
1,5 - 2 |
0,4 |
5 - 6,7 |
|
2 - 2,5 |
0,5 |
5 - 6,3 |
|
2,5 - 3 |
0,6 |
5 - 6 |
|
3 - 3,5 |
0,7 |
5 - 5,8 |
|
3,5 - 4 |
0,8 |
5 - 5,7 |
|
4 - 5 |
1 |
5 - 6,3 |
|
5 - 6 |
1,2 |
5 - 6 |
|
6 - 7 |
1,4 |
5 - 5,8 |
|
7 - 8 |
1,6 |
5 - 5,7 |
|
8 - 9 |
1,8 |
5 - 5,6 |
|
9 - 10 |
2 |
5 - 5,6 |
K určení správné dávky je nutno pacienta co nejpřesněji zvážit, aby se předešlo poddávkování.
K usnadnění přesného dávkování je k 15 ml lahvičce Verafloxu dodávána perorální dávkovací stříkačka o objemu 3 ml (stupnice 0,1 až 2 ml),
Doba léčby
Délka terapie závisí na povaze a závažnosti infekce a na úspěšnosti léčby. Pro většinu infekcí jsou následující doby léčby dostačující:
|
Indikace |
Délka terapie (dny) |
|
Infekce ran a abscesy |
7 |
|
Akutní infekce horních cest dýchacích |
5 |
Léčba by měla být znovu posouzena, pokud není pozorováno zlepšení stavu 3 dny od zahájení léčby.
Způsob _ podání
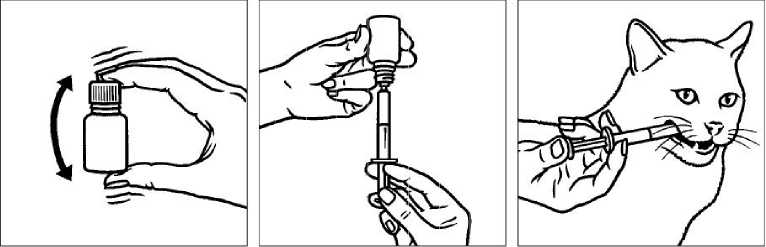
Před použitím dobře protřepejte.
Natáhněte příslušnou dávku do stříkačky.
Aplikujte přímo do dutiny ústní.
Z důvodu předcházení přenosu infekce, nepoužívejte jednu dávkovací stříkačku pro více zvířat. Jedna stříkačka by měla být použita pouze pro jedno zvíře. Po použití by měla být stříkačka opláchnuta čistou vodou a uchovávána v papírové krabičce spolu s veterinárním léčivým přípravkem.
4.10 Předávkování (symptomy, první pomoc, antidota)
Nejsou známa specifická antidota pradofloxacinu (nebo jiných fluorochinolonů), proto by v případě předávkování měla být podávána symptomatická léčba.
Bylo pozorováno občasné zvracení u koček po opakovaném podávání 1,6 násobku maximální doporučené dávky.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Antibakteriální látky pro systémové použití, fluorochinolony. ATCvet kód: QJ01MA97
5.1 Farmakodynamické vlastnosti
Způsob účinku
Primární způsob účinku fluorochinolonů spočívá v interakci s enzymy nezbytnými pro hlavní funkce DNA, jako jsou replikace, transkripce a rekombinace. Primárními cíli pro pradofloxacin jsou bakteriální enzymy DNA gyrázy a topoisomerázy IV. Reversibilní asociace mezi pradofloxacinem a DNA gyrázou nebo DNA topoisomerázou IV v cílové baktérii vede k inhibici těchto enzymů a k rychlé smrti bakteriální buňky. Rychlost a rozsah smrtícího účinku na bakterie jsou v přímé úměře ke koncentraci léčiva.
Antibakteriální spektrum
Ačkoliv má pradofloxacin účinek in-vitro na široké spektrum grampozitivních a gramnegativních organismů, včetně anaerobních bakterií, tento veterinární léčivý přípravek by měl být použit pouze na schválené indikace (viz bod 4.2) a v souladu s upozorněním o indikačním omezení v bodě 4.5 tohoto SPC.
Údaje o MIC
|
Bakteriální druhy |
Počet kmenů |
MIC50 (pg/ml) |
MIC90 (pg/ml) |
Rozmezí MIC (pg/ml) |
|
Pasteurella multocida |
323 |
0,016 |
0,016 |
0,002-0,062 |
|
Escherichia coli |
135 |
0,016 |
4 |
0,008-8 |
|
skupina Staphylococcus intermedius (Včetně S. pseudintermedius) |
184 |
0,062 |
0,125 |
0,016-8 |
Jedná se o bakteriální izoláty získané mezi lety 2001 až 2007 z klinických případů v Belgii, Francii, Německu, Maďarsku, Polsku, Švédsku a Velké Británii.
Druhy a mechanismy vzniku rezistence
Podle studií vzniká rezistence na fluorochinolony z pěti příčin, (i) bodové mutace genů kódujících DNA gyrázu a/nebo topoisomerázu IV, jež způsobují změny těchto enzymů, (ii) změny permeability přípravku gramnegativními bakteriemi, (iii) mechanismus efluxu, (iv) rezistence zprostředkovaná plazmidy a (v) proteiny chránící gyrázu. Všechny tyto mechanismy vyvolávají sníženou citlivost bakterií na fluorochinolony. Častá je také zkřížená rezistence v rámci třídy fluorochinolonů.
5.2 Farmakokinetické údaje
Laboratorní studie ukázaly, že u nakrmených koček byla snížena biologická dostupnost pradofloxacinu v porovnání s lačnými zvířaty. Nicméně klinické studie neodhalily žádný vliv krmení na efekt léčby.
Po perorálním podání doporučené terapeutické dávky přípravku veterinárního léčivého přípravku kočkám, se pradofloxacin rychle absorbuje a dosahuje maximální koncentrace 2,1 mg/l během 1 hodiny. Biologická dostupnost veterinárního léčivého přípravku je minimálně 60%. Opakovaná dávka neměla žádný dopad na farmakokinetický profil (akumulační index = 1,2). Vazba na plazmatické proteiny in vitro je nízká (30%). Velký distribuční objem (Vd) >4 l/kg živé hmotnosti je známkou dobré tkáňové prostupnosti. Pradofloxacin je eliminován ze séra s konečným biologickým poločasem 7 hodin. Hlavní cesta vylučování u koček je glukuronidace. Clearance pradofloxacinu z těla je 0,28 l/h/kg.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Polakrilin Kyselina sorbová Kyselina askorbová
Xantanová klovatina Propylenglykol Vanilkové aroma Čištěná voda
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento veterinární léčivý přípravek nesmí být mísen s žádnými dalšími veterinárními léčivými přípravky.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky Doba použitelnosti po prvním otevření vnitřního obalu: 3 měsíce
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu.
Uchovávejte v dobře uzavřeném vnitřním obalu.
6.5 Druh a složení vnitřního obalu
Veraflox perorální suspenze je dodávána ve 2 různých baleních:
Papírová krabička obsahující 15 ml bílou lahvičku z polyethylénu vysoké hustoty (HDPE) s polyethylénovým nástavcem a dětským bezpečnostním uzávěrem a 3 ml polypropylénovou perorální dávkovací stříkačkou (stupnice: 0,1- 2ml).
Papírová krabička obsahující 30 ml bílou lahvičku z polyethylénu vysoké hustoty (HDPE) s dětským bezpečnostním uzávěrem.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/10/107/013-014
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum registrace: 12/04/2011
Datum posledního prodloužení: DD/MM/RRRR
10. DATUM REVIZE TEXTU
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
Neuplatňuje se.
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
C. DEKLARACE HODNOT MRL
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce odpovědného za uvolnění šarží: KVP Pharma + Veterinář Produkte GmbH Projensdorfer Strasse 324 D-24106 Kiel Německo
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
C- DEKLARACE HODNOT MRL
Neuplatňuje se.
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Papírová krabička obsahující 1 blistr (1 x 7 tablet 15 mg) Papírová krabička obsahující 3 blistry (3 x 7 tablet 15 mg) Papírová krabička obsahující 10 blistrů (10 x 7 tablet 15 mg) Papírová krabička obsahující 20 blistrů (20 x 7 tablet 15 mg)
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 15 mg tablety pro psy a kočky pradofloxacinum
2. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá tableta obsahuje 15 mg pradofloxacinum
3. LÉKOVÁ FORMA
Tablety
4. VELIKOST BALENÍ
7 tablet 21 tablet 70 tablet 140 tablet
5. CÍLOVÝ DRUH ZVÍŘAT
Psi a kočky
6. INDIKACE
7. ZPŮSOB A CESTA PODÁNÍ
Perorální podání.
Před použitím čtěte příbalovou informaci.
8. OCHRANNÁ LHŮTA
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á)
Před použitím čtěte příbalovou informaci.
10. DATUM EXPIRACE
EXP {měsíc/rok}
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, pokud je jich potřeba_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOHLED A DOSAH DĚTÍ“
Uchovávejte mimo dohled a dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
16. REGISTRAČNÍ ČÍSLA
EU/2/10/107/001 7 tablet EU/2/10/107/002 21 tablet EU/2/10/107/003 70 tablet EU/2/10/107/004 140 tablet
17. ČÍSLO ŠARŽE OD VÝROBCE
Papírová krabička obsahující 1 blistr (1 x 7 tablet 60 mg) Papírová krabička obsahující 3 blistry (3 x 7 tablet 60 mg) Papírová krabička obsahující 10 blistrů (10 x 7 tablet 60 mg) Papírová krabička obsahující 20 blistrů (20 x 7 tablet 60 mg)
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 60 mg tablety pro psy pradofloxacinum
2. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá tableta obsahuje 60 mg pradofloxacinum
3. LÉKOVÁ FORMA
Tablety
4. VELIKOST BALENÍ
7 tablet 21 tablet 70 tablet 140 tablet
5. CÍLOVÝ DRUH ZVÍŘAT
Psi
6. INDIKACE
7. ZPŮSOB A CESTA PODÁNÍ
Perorální podání.
Před použitím čtěte příbalovou informaci.
8. OCHRANNÁ LHŮTA
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á)
10. DATUM EXPIRACE
EXP {měsíc/rok}
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, pokud je jich potřeba_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOHLED A DOSAH DĚTÍ“
Uchovávejte mimo dohled a dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
16. REGISTRAČNÍ ČÍSLA
EU/2/10/107/005 7 tablet EU/2/10/107/006 21 tablet EU/2/10/107/007 70 tablet EU/2/10/107/008 140 tablet
17. ČÍSLO ŠARŽE OD VÝROBCE
Papírová krabička obsahující 1 blistr (1 x 7 tablet 120 mg) Papírová krabička obsahující 3 blistry (3 x 7 tablet 120 mg) Papírová krabička obsahující 10 blistrů (10 x 7 tablet 120 mg) Papírová krabička obsahující 20 blistrů (20 x 7 tablet 120 mg)
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 120 mg tablety pro psy pradofloxacinum
2. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá tableta obsahuje 120 mg pradofloxacinum
3. LÉKOVÁ FORMA
Tablety
4. VELIKOST BALENÍ
7 tablet 21 tablet 70 tablet 140 tablet
5. CÍLOVÝ DRUH ZVÍŘAT
Psi
6. INDIKACE
7. ZPŮSOB A CESTA PODÁNÍ
Perorální podání.
Před použitím čtěte příbalovou informaci.
8. OCHRANNÁ LHŮTA
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á)
10. DATUM EXPIRACE
EXP {měsíc/rok}
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH POTŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, pokud je jich potřeba_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOHLED A DOSAH DĚTÍ“
Uchovávejte mimo dohled a dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
16. REGISTRAČNÍ ČÍSLA
EU/2/10/107/009 7 tablet EU/2/10/107/010 21 tablet EU/2/10/107/011 70 tablet EU/2/10/107/012 140 tablet
17. ČÍSLO ŠARŽE OD VÝROBCE
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 15 mg tablety pradofloxacinum

2. JMÉNO DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer
3. DATUM EXPIRACE
EXP {měsíc/rok}
4. ČÍSLO ŠARŽE
Lot {číslo}
5. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 60 mg tablety pradofloxacinum
2. JMÉNO DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer
3. DATUM EXPIRACE
EXP {měsíc/rok}
4. ČÍSLO ŠARŽE
Lot {číslo}
5. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 120 mg tablety pradofloxacinum
2. JMÉNO DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer
3. DATUM EXPIRACE
EXP {měsíc/rok}
4. ČÍSLO ŠARŽE
Lot {číslo}
5. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
Papírová krabička obsahující polyetylénovou (HDPE) lahvičku (15 ml perorální suspenze)
Veraflox 25 mg/ml perorální suspenze pro kočky pradofloxacinum
Pradofloxacinum 25 mg/ml Konzervační látka: kyselina sorbová (E200)
Perorální suspenze
15 ml lahvička a 3 ml perorální dávkovači stříkačka
Kočky
Perorální podání.
Před použitím dobře protřepejte.
Před použitím čtěte příbalovou informaci.
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á)
Vyhněte se kontaminaci přípravkem během použití.
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu. Uchovávejte v dobře uzavřené lahvičce.
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH POTŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, pokud je jich potřeba_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVEJTE MIMO DOHLED A DOSAH DĚTÍ“
Uchovávejte mimo dohled a dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
16. REGISTRAČNÍ ČÍSLO
EU/2/10/107/013
17. ČÍSLO ŠARŽE OD VÝROBCE
Č.š. {číslo}
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 25 mg/ml perorální suspenze pro kočky pradofloxacinum
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)
Pradofloxacinum 25 mg/ml
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
15 ml
4. CESTA(Y) PODÁNÍ
Perorální podání.
Před použitím dobře protřepejte.
5. ČÍSLO ŠARŽE
Č.š. {číslo}
6. DATUM EXPIRACE
EXP {měsíc/rok}
Po prvním otevření spotřebujte do
7. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 25 mg/ml perorální suspenze pro kočky pradofloxacinum
2. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Pradofloxacinum 25 mg/ml Konzervační látka: kyselina sorbová (E200)
3. LÉKOVÁ FORMA
Perorální suspenze
4. VELIKOST BALENÍ
30 ml lahvičkou
5. CÍLOVÝ DRUH ZVÍŘAT
Kočky
6. INDIKACE
7. ZPŮSOB A CESTA PODÁNÍ
Perorální podání.
Před použitím dobře protřepejte.
Před použitím čtěte příbalovou informaci.
8. OCHRANNÁ LHŮTA
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á)
Vyhněte se kontaminaci přípravkem během použití.
10. DATUM EXPIRACE
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v původním obalu. Uchovávejte v dobře uzavřené lahvičce.
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH POTŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, pokud je jich potřeba_
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVEJTE MIMO DOHLED A DOSAH DĚTÍ“
Uchovávejte mimo dohled a dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Bayer Animal Health GmbH D-51368 Leverkusen Německo
16. REGISTRAČNÍ ČÍSLO(A)
EU/2/10/107/014
17. ČÍSLO ŠARŽE OD VÝROBCE
Č.š. {číslo}
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 25 mg/ml perorální suspenze pro kočky pradofloxacinum
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)
Pradofloxacinum 25 mg/ml
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
30 ml
4. CESTA(Y) PODÁNÍ
Perorální podání.
Před použitím dobře protřepejte.
5. ČÍSLO ŠARŽE
Č.š. {číslo}
6. DATUM EXPIRACE
EXP {měsíc/rok}
Po prvním otevření spotřebujte do
7. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
Veraflox 15 mg tablety pro psy a kočky
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci: Bayer Animal Health GmbH D-51368 Leverkusen Německo
Výrobce odpovědný za uvolnění šarže: KVP Pharma + Veterinar Produkte GmbH Projensdorfer Str. 324 D-24106 Kiel Německo
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 15 mg tablety pro psy a kočky pradofloxacinum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá tableta obsahuje:
Léčivá látka:
Pradofloxacin 15 mg
Nahnědlé tablety s půlící rýhou a s „P15“ na jedné straně
Tabletu lze rozdělit na stejné dávky.
4. INDIKACE
Psi:
Léčba:
• infekcí ran vyvolaných citlivými kmeny skupiny Staphylococcus intermedius (včetně
S. pseudintermedius),
• povrchových a hlubokých pyodermií vyvolaných citlivými kmeny skupiny Staphylococcus intermedius (včetně S. pseudintermedius),
• akutních infekcí močového traktu vyvolaných citlivými kmeny Escherichia coli a skupiny Staphylococcus intermedius (včetně S. pseudintermedius) a
• jako terapie doplňující mechanické čištění nebo chirurgickou periodontální léčbu těžkých infekcí dásní a periodontálních tkání vyvolaných citlivými kmeny anaerobních bakterií například Porphyromonas spp. a Prevotella spp. (viz část “Zvláštní upozornění“).
Kočky:
Léčba:
• akutních infekcí horních cest dýchacích vyvolaných citlivými kmeny Pasteurella multocida, Escherichia coli a skupiny Staphylococcus intermedius (včetně S. pseudintermedius).
5. KONTRAINDIKACE
Nepoužívat u zvířat se známou přecitlivělostí na fluorochinolony.
Psi:
Nepoužívat u psů během období růstu, protože by mohlo dojít k poškození kloubních chrupavek. Období růstu psů závisí na plemeni; pro většinu plemen platí, že se nesmí používat veterinární léčivé přípravky obsahující pradofloxacin u psů mladších 12 měsíců, u obrovských plemen se použití nedoporučuje do stáří 18 měsíců.
Nepoužívat u psů s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívat u psů s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u psů během březosti a laktace.(viz část “Zvláštní upozornění“).
Kočky:
Pro absenci dostupných informací se nedoporučuje podávat pradofloxacin u koťat mladších 6 týdnů.
Pradofloxacin nepoškozuje vývoj chrupavek u koťat ve věku 6 týdnů a starších. Avšak přípravek není vhodný pro kočky s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívat u koček s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u koček během březosti a laktace (viz část “Zvláštní upozornění“).
6. NEŽÁDOUCÍ ÚČINKY
Ve vzácných případech byly u psů a koček pozorovány mírné přechodné trávicí poruchy včetně zvracení.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi, kočky.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Perorální podání.
Dávkování
Doporučená dávka je 3 mg pradofloxacinu/kg živé hmotnosti jedenkrát denně podle následujících tabulek.
K určení správné dávky je nutno pacienta co nejpřesněji zvážit, aby se předešlo poddávkování. Pokud dávkování vyžaduje podání jen poloviny tablety, zbývající část tablety má být použita při příštím podání.
Psi:
|
Živá hmotnost psů (kg) |
Počet 15 mg tablet |
Dávka pradofloxacinu (mg/kg ž.hm.) |
|
>3,4 - 5 |
1 |
3 - 4,4 |
|
5 - 7,5 |
1/ |
3 - 4,5 |
|
7,5 - 10 |
2 |
3 - 4 |
|
10 - 15 |
3 |
3- 4,5 |
|
Pro psy s hmotností nad 15 kg použijte tablety s 60 mg nebo 120 mg pradofloxacinu. | ||
Kočky:
|
Živá hmotnost koček (kg) |
Počet 15 mg tablet |
Dávka pradofloxacinu (mg/kg ž.hm.) |
|
>3,4 - 5 |
1 |
3 - 4,4 |
|
5 - 7,5 |
1/ |
3- 4,5 |
|
7,5 - 10 |
2 |
3 - 4 |
Doba léčby
Léčba by měla trvat tak dlouho, jak doporučil váš veterinární lékař. Délka terapie závisí na povaze a závažnosti infekce a také na tom, j ak léčba zabírá v případě vašeho zvířete. Pro většinu infekcí j sou doporučeny následující doby léčby:
Psi:
|
Indikace |
Délka terapie (dny) |
|
Infekce kůže: | |
|
Superficiální pyodermie |
14 - 21 |
|
Hluboká pyodermie |
14 - 35 |
|
Infekce ran |
7 |
|
Akutní infekce močového traktu |
7 - 21 |
|
Těžké infekce dásní a periodontálních tkání |
7 |
Poraďte se s vaším veterinárním lékařem, pokud není pozorováno zlepšení klinického stavu 3 dny od zahájení léčby, i když v případech povrchové pyodermie může být tato doba zvýšena na 7 dní a v případech hluboké pyodermie na 14 dní.
Kočky:
|
Indikace |
Délka terapie (dny) |
|
Akutní infekce horních cest dýchacích |
5 |
Poraďte se s vaším veterinárním lékařem, pokud není pozorováno zlepšení stavu 3 dny od zahájení léčby.
9. POKYNY PRO SPRÁVNÉ PODÁVÁNÍ
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávejte mimo dohled a dosah dětí.
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání. Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnosti uvedené na etiketě.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní opatření pro použití u zvířat:
Pokud je to možné, Veraflox by měl být používán pouze na základě výsledků testů citlivosti.
Při podávání přípravku je nutno zohlednit oficiální a místní antimikrobiální politiku.
Je vhodné využívat fluorochinolony pouze pro léčbu klinických onemocnění, které špatně odpovídají nebo u kterých se předpokládá, že budou špatně reagovat na léčbu jinou skupinou antibiotik.
Použití přípravku v rozporu s pokyny uvedenými v SPC může zvýšit počet bakterií rezistentních na fluorochinolony a také snížit účinnost terapie ostatními fluorochinolony v důsledku zkřížené rezistence.
Pyodermie vznikají většinou sekundárně následkem primárního onemocnění, a proto se doporučuje diagnostikovat primární příčinu zdravotní poruchy a zaměřit se na její léčbu.
Veraflox by měl být použit pouze ve vážných případech periodontálních onemocnění. Základem dlouhodobé úspěšné léčby je mechanické vyčištění zubů a odstranění zubního plaku a kamene nebo extrakce zubů. V případě gingivitidy nebo periodontitidy lze využít Veraflox pouze jako doplněk k mechanickému čištění nebo chirurgické léčbě periodontu. Tento veterinární léčivý přípravek by měl být podáván jen psům, u nichž nelze dosáhnout vyléčení pouze mechanickým čištěním.
Pradofloxacin může zvýšit citlivost kůže na sluneční záření. Během terapie by proto zvířata neměla být vystavena nadměrnému slunečnímu záření.
Sdělte Vašemu veterináři, pokud má Vaše zvíře poškozenou funkci ledvin. Vylučování ledvinami je důležitá cesta eliminace pradofloxacinu u psů, a proto by měl být pradofloxacin použit jen po pečlivém zvážení u zvířat s poškozenou funkcí ledvin.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům:
Vzhledem k možnému škodlivému účinku, musí být tablety uchovávány mimo dosah dětí.
Lidé se známou přecitlivělostí na chinolony by se měli vyvarovat kontaktu s tímto veterinárním léčivým přípravkem.
Zamezte kontaktu přípravku s kůží nebo očima. Umyjte si řádně ruce po použití přípravku.
Nejezte, nepijte a nekuřte při manipulaci s tímto veterinárním léčivým přípravkem.
V případě náhodného požití vyhledejte lékařskou pomoc a příbalovou informaci nebo etiketu produktu ukažte praktickému lékaři.
Březost, laktace a plodnost:
Bezpečnost Verafloxu u psů a koček během březosti a laktace nebyla stanovena.
Březost:
Nepoužívejte během březosti. Pradofloxacin způsobil oční malformace při podávání potkanům ve fetálních a maternálních toxických dávkách.
Laktace:
Nepoužívejte během laktace. Laboratorní studie u štěňat prokázaly vznik artropatií (poškození chrupavek kloubů) po systémovém podávání fluorochinolonů. Je známo, že fluorochinolony přestupují přes placentu a dostávají se do mléka.
Plodnost:
Bylo prokázáno, že pradofloxacin nemá žádný účinek na plodnost u chovných zvířat.
Interakce s dalšími léčivými přípravky a další formy interakce:
Jsou některé léky, které by neměly být souběžně podávány vašemu zvířeti po dobu léčby, protože mohou způsobit vážné nežádoucí účinky. Sdělte Vašemu veterináři všechny léky, které máte v úmyslu podat zvířeti.
Veraflox by neměl být podáván společně s antacidy nebo sukralfátem (používané při žaludeční kyselosti), multivitaminy nebo mléčnými výrobky, jelikož může dojít k poklesu absorpce Verafloxu. Dále by Veraflox neměl být podáván v kombinaci s nesteroidními antiflogistiky (NSAIDs, používanými na léčbu bolesti, horečky nebo zánětu) zvířatům trpícím záchvaty z důvodu možného zvýšeného rizika záchvatu. Fluorochinolony by se neměly kombinovat s teophylinem (používaný při chronických respiratorních onemocněních) nebo s digoxinem (používaný při kongestivním srdečním selhání) z důvodu možného zvýšení krevních hladin těchto léků, což může zvýšit účinek těchto léků.
Předávkování: (symptomy, první pomoc, antidota):
Při předávkování může být pozorováno zvracení a měkká stolice.
Nejsou známa specifická antidota pradofloxacinu (nebo jiných fluorochinolonů), proto by v případě předávkování měla být podávána symptomatická léčba.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z těchto přípravků, musí být likvidován podle místních právních předpisů.
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/
15. DALŠÍ INFORMACE
Následující velikosti balení jsou k dispozici:
- 7 tablet
- 21 tablet
- 70 tablet
- 140 tablet
Na trhu nemusí být všechny velikosti balení.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien Bayer SA-NV J.E. Mommaertslaan 14 BE-1831 Diegem (Machelen) Tel/Tél: +32 2 535 66 54 |
Lietuva Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
|
Peny6^HKa Bt^rapnn Bt3pa^gaHe-KacHC OOfl 6yn. Etnrapna 102-4 BG ^OBeu 5500 Ten: + 359 68 604 111 |
Luxembourg/Luxemburg Bayer SA-NV J.E. Mommaertslaan 14 BE-1831 Diegem (Machelen) Belgique/Belgien Tél/Tel: +32 2 535 66 54 |
|
Česká republika Bayer s.r.o., Animal Health Siemensova 2717/4 CZ-155 00 Praha 5 Tel: +420 2 66 10 14 71 |
Magyarország Bayer Hungária Kft. HU-1123 Budapest Alkotás u. 50 Tel: +36 1 487 4100 |
|
Danmark Bayer A/S, Bayer HealthCare Animal Health Division Arne Jacobsens Allé 13 DK-2300 Kobenhavn S Tlf: +45 4523 5000 |
Malta Bayer Animal Health GmbH DE-51368 Leverkusen Germany Tel: +49 2173 38 4012 |
|
Deutschland Bayer Vital GmbH Geschaftsbereich Tiergesundheit DE-51368 Leverkusen Tel: +49 214 301 |
Nederland Bayer B.V., Animal Health Division Energieweg 1 NL-3641 RT Mijdrecht Tel: +31 297 280 666 |
|
Eesti Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
Norge Bayer AS Bayer HealthCare Animal Health Division Drammensveien 147 B NO-0277 Oslo Tlf: +47 24 11 18 00 |
|
EXláSa PROVET S.A. NiKq^ópou ®©Ká & Ay. Avapyóprov ©éon BpayKÓ EL-193 00 Aonpónupyog, Attik^ T@: +30 210 5575770-3 info@provet.gr |
Osterreich Bayer Austria GmbH Geschaftsbereich Tiergesundheit HerbststraBe 6 - 10 AT-1160 Wien Tel: +43 1 71146 2850 vet@bayer.at |
|
Espaňa Bayer Hispania, S.L. División Sanidad Animal Av. Baix Llobregat, 3-5 ES-08970 Sant Joan Despí (Barcelona) Tel: +34 93 4956500 |
Polska Bayer Sp. z o.o. Animal Health Al. Jerozolimskie 158 PL-02-326 Warszawa Tel: +48 22 572 35 00 |
|
France Bayer HealthCare Division Animal Health 13, rue Jean Jaures FR-92807 Puteaux Cedex Tél: +33 1 49 06 56 00 |
Portugal Bayer Portugal S.A. Divisao de Saúde Animal Rua da Quinta do Pinheiro, 5 PT-2794-003 Carnaxide Tel: +351 21 4172121 |
|
Hrvatska Bayer d.o.o. Radnička cesta 80 HR-10000 Zagreb Tel: +385 1 65 99 935 bayer.veterina.registracije@bayer.com |
Románia S.C. Bayer S.R.L. Sos. Pipera nr. 42, sector 2 Bucuresti 020112 - RO Tel: +40 21 529 5900 |
|
Ireland Bayer Limited, Animal Health Division The Atrium, Blackthorn Road IE - Dublin 18 Tel: +353 1 2999313 |
Slovenija Bayer d.o.o. Bravničarjeva 13 SI-1000 Ljubljana Tel: +386 1 5814 400 |
|
Ísland Icepharma hf. Lynghálsi 13 IS-110 Reykjavík Sími: +354 540 8000 |
Slovenská republika Bayer s.r.o., Animal Health Siemensova 2717/4 CZ-155 00 Praha 5 Česká republika Tel: +420 2 66 10 14 71 |
|
Italia Bayer S.p.A. Viale Certosa, 130 |
Suomi/Finland Orion Oyj ORION PHARMA ELÁINLÁÁKKEET |
|
IT-20156 Milano Tel: +39 02 3978 1 |
Tengstrominkatu 8, PL/PB 425 FI-20101 Turku/Ábo Puh/Tel: +358 10 4261 |
|
Kúrcpog ACTIVET Ltd. Avxpéa Miaoú^n 50 CY-2415 'EyK^^n, AsuK^aía Tqk +357-22-591918 |
Sverige Bayer A/S, Bayer HealthCare Animal Health Division Arne Jacobsens Allé 13 DK-2300 Kopenhamn S Danmark Tel: +46 (0)8-580 223 00 |
|
Latvija Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
United Kingdom Bayer plc, Animal Health Division, Bayer House, Strawberry Hill, Newbury, Berkshire RG14 1JA-UK Tel: +44 1635 563000 |
PŘÍBALOVÁ INFORMACE PRO
Veraflox 60 mg a 120 mg tablety pro psy
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci: Bayer Animal Health GmbH D-51368 Leverkusen Německo
Výrobce odpovědný za uvolnění šarže: KVP Pharma +Veterinar Produkte GmbH Projensdorfer Str. 324 D-24106 Kiel Německo
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 60 mg tablety pro psy Veraflox 120 mg tablety pro psy pradofloxacinum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Každá tableta obsahuje:
Léčivá látka:
Pradofloxacinum 60 mg
Pradofloxacinum 120 mg
Nahnědlé tablety s půlící rýhou a s „P60“ na jedné straně
Nahnědlé tablety s půlící rýhou a s „P120“ na jedné straně
Tabletu lze rozdělit na stejné dávky.
4. INDIKACE
Psi:
Léčba:
• infekcí ran vyvolaných citlivými kmeny skupiny Staphylococcus intermedius (včetně
S. pseudintermedius),
• povrchových a hlubokých pyodermií vyvolaných citlivými kmeny skupiny Staphylococcus intermedius (včetně S. pseudintermedius),
• akutních infekcí močového traktu vyvolaných citlivými kmeny Escherichia coli a skupiny Staphylococcus intermedius (včetně S. pseudintermedius) a
• jako terapie doplňující mechanické čištění nebo chirurgickou periodontální léčbu těžkých infekcí dásní a periodontálních tkání vyvolaných citlivými kmeny anaerobních bakterií například Porphyromonas spp. a Prevotella spp. (viz část “Zvláštní upozornění“).
5. KONTRAINDIKACE
Nepoužívat u zvířat se známou přecitlivělostí na fluorochinolony.
Nepoužívat u psů během období růstu, protože by mohlo dojít k poškození kloubních chrupavek. Období růstu psů závisí na plemeni; pro většinu plemen platí, že se nesmí používat veterinární léčivé přípravky obsahující pradofloxacin u psů mladších 12 měsíců, u obrovských plemen se použití nedoporučuje do stáří 18 měsíců.
Nepoužívat u psů s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívat u psů s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u psů během březosti a laktace. (viz část “Zvláštní upozornění“).
6. NEŽÁDOUCÍ ÚČINKY
Ve vzácných případech byly u psů pozorovány mírné přechodné trávicí poruchy včetně zvracení.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Perorální podání.
Dávkování
Doporučená dávka je 3 mg pradofloxacinu/kg živé hmotnosti. jedenkrát denně podle následujících tabulek. K určení správné dávky je nutno pacienta co nejpřesněji zvážit, aby se předešlo poddávkování. Pokud dávkování vyžaduje podání jen poloviny tablety, zbývající část tablety má být použita při příštím podání.
|
Živá hmotnost psů (kg) |
Počet tablet |
Dávka pradofloxacinu (mg/kg ž.hm.) |
|
60 mg 120 mg | ||
|
Pro psy do 15 kg použijte tablety s 15 mg pradofloxacinu. | ||
|
15 - 20 1 |
3 - 4 | |
|
20 - 30 |
1/ |
3 - 4,5 | |
|
30 - 40 |
1 |
3 - 4 | |
|
40 - 60 |
1/ |
3 - 4,5 | |
|
60 - 80 |
2 |
3 - 4 |
Doba léčby
Léčba by měla trvat tak dlouho, jak doporučil váš veterinární lékař. Délka terapie závisí na povaze a závažnosti infekce a také na tom, jak léčba zabírá v případě vašeho zvířete. Pro většinu infekcí jsou doporučeny následující doby léčby:
|
Indikace |
Délka terapie (dny) |
|
Infekce kůže: | |
|
Superficiální pyodermie |
14 - 21 |
|
Hluboká pyodermie |
14 - 35 |
|
Infekce ran |
7 |
|
Akutní infekce močového traktu |
7 - 21 |
|
Těžké infekce dásní a periodontálních tkání |
7 |
Poraďte se s vaším veterinárním lékařem, pokud není pozorováno zlepšení klinického stavu 3 dny od zahájení léčby, i když v případech povrchové pyodermie může být tato doba zvýšena na 7 dní a v případech hluboké pyodermie na 14 dní.
9. POKYNY PRO SPRÁVNÉ PODÁVÁNÍ
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávejte mimo dohled a dosah dětí.
Tento veterinární léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání. Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnosti uvedené na etiketě.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní opatření pro použití u zvířat:
Pokud je to možné, Veraflox by měl být používán pouze na základě výsledků testů citlivosti.
Při podávání přípravku je nutno zohlednit oficiální a místní antimikrobiální politiku.
Je vhodné využívat fluorochinolony pouze pro léčbu klinických onemocnění, které špatně odpovídají nebo u kterých se předpokládá, že budou špatně reagovat na léčbu jinou skupinou antibiotik.
Použití přípravku v rozporu s pokyny uvedenými v SPC může zvýšit počet bakterií rezistentních na fluorochinolony a také snížit účinnost terapie ostatními fluorochinolony v důsledku zkřížené rezistence.
Pyodermie vznikají většinou sekundárně následkem primárního onemocnění, a proto se doporučuje diagnostikovat primární příčinu zdravotní poruchy a zaměřit se na její léčbu.
Veraflox by měl být použit pouze ve vážných případech periodontálních onemocnění. Základem dlouhodobé úspěšné léčby je mechanické vyčištění zubů a odstranění zubního plaku a kamene nebo extrakce zubů. V případě gingivitidy nebo periodontitidy lze využít Veraflox pouze jako doplněk k mechanickému čištění nebo chirurgické léčbě periodontu. Tento veterinární léčivý přípravek by měl být podáván jen psům, u nichž nelze dosáhnout vyléčení pouze mechanickým čištěním.
Pradofloxacin může zvýšit citlivost kůže na sluneční záření. Během terapie by proto zvířata neměla být vystavena nadměrnému slunečnímu záření.
Sdělte Vašemu veterináři, pokud má Váš pes poškozenou funkci ledvin. Vylučování ledvinami je důležitá cesta eliminace pradofloxacinu u psů, a proto by měl být pradofloxacin použit jen po pečlivém zvážení u zvířat s poškozenou funkcí ledvin.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům...
Vzhledem k možnému škodlivému účinku, musí být tablety uchovávány mimo dosah dětí.
Lidé se známou přecitlivělostí na chinolony by se měli vyvarovat kontaktu s tímto veterinárním léčivým přípravkem.
Zamezte kontaktu přípravku s kůží nebo očima. Umyjte si řádně ruce po použití přípravku.
Nejezte, nepijte a nekuřte při manipulaci s tímto veterinárním léčivým přípravkem.
V případě náhodného požití vyhledejte lékařskou pomoc a příbalovou informaci nebo etiketu produktu ukažte praktickému lékaři.
Březost, laktace a plodnost:
Bezpečnost Verafloxu u psů během březosti a laktace nebyla stanovena.
Březost:
Nepoužívejte během březosti. Pradofloxacin způsobil oční malformace při podávání potkanům ve fetálních a maternálních toxických dávkách.
Laktace:
Nepoužívejte během laktace. Laboratorní studie u štěňat prokázaly vznik artropatií (poškození chrupavek kloubů) po systémovém podávání fluorochinolonů. Je známo, že fluorochinolony přestupují přes placentu a dostávají se do mléka.
Plodnost:
Bylo prokázáno, že pradofloxacin nemá žádný účinek na plodnost u chovných zvířat.
Interakce s dalšími léčivými přípravky a další formy interakce:
Jsou některé léky, které by neměly být souběžně podávány vašemu zvířeti po dobu léčby, protože mohou způsobit vážné nežádoucí reakce. Sdělte Vašemu veterináři všechny léky, které máte v úmyslu podat zvířeti.
Veraflox by neměl být podáván společně s antacidy nebo sukralfátem (používané při žaludeční kyselosti), multivitaminy nebo mléčnými výrobky, jelikož může dojít k poklesu absorpce Verafloxu. Dále by Veraflox neměl být podáván v kombinaci s nesteroidními antiflogistiky (NSAIDs, používanými na léčbu bolesti, horečky nebo zánětu) zvířatům trpícím záchvaty z důvodu možného zvýšeného rizika záchvatu. Fluorochinolony by se neměly kombinovat s teophylinem (používaný při chronických respiratorních onemocněních) nebo s digoxinem (používaný při kongestivním srdečním selhání) z důvodu možného zvýšení krevních hladin těchto léků, což může zvýšit účinek těchto léků.
Předávkování: (symptomy, první pomoc, antidota)
Při předávkování může být pozorováno zvracení a měkká stolice.
Nejsou známa specifická antidota pradofloxacinu (nebo jiných fluorochinolonů), proto by v případě předávkování měla být podávána symptomatická léčba.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z těchto přípravků, musí být likvidován podle místních právních předpisů.
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/
15. DALŠÍ INFORMACE
Následující velikosti balení jsou k dispozici:
- 7 tablet
- 21 tablet
- 70 tablet
- 140 tablet
Na trhu nemusí být všechny velikosti balení.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien |
Lietuva |
|
Bayer SA-NV |
Magnum Veterinaaria AS |
|
J.E. Mommaertslaan 14 |
Vae 16 |
|
BE-1831 Diegem (Machelen) |
EE-76401 Laagri |
|
Tel/Tél: +32 2 535 66 54 |
Tel: +372 650 1920 |
|
Peny6^HKa Bt^rapnn |
Luxembourg/Luxemburg |
|
Bt3pa^gaHe-Kacuc OOfl |
Bayer SA-NV |
|
6yn. Etnrapun 102-4 |
J.E. Mommaertslaan 14 |
|
BG ^OBeu 5500 |
BE-1831 Diegem (Machelen) |
|
Ten: + 359 68 604 111 |
Belgique/Belgien |
|
Tél/Tel: +32 2 535 66 54 | |
|
Česká republika |
Magyarország |
|
Bayer s.r.o., Animal Health Siemensova 2717/4 |
Bayer Hungária Kft. HU-1123 Budapest |
|
CZ-155 00 Praha 5 |
Alkotás u. 50 |
|
Tel: +420 2 66 10 14 71 |
Tel: +36 1 487 4100 |
|
Danmark Bayer A/S, Bayer HealthCare Animal Health Division Arne Jacobsens Allé 13 DK-2300 Kobenhavn S Tlf: +45 4523 5000 |
Malta Bayer Animal Health GmbH DE-51368 Leverkusen Germany Tel: +49 2173 38 4012 |
|
Deutschland Bayer Vital GmbH Geschaftsbereich Tiergesundheit DE-51368 Leverkusen Tel: +49 214 301 |
Nederland Bayer B.V., Animal Health Division Energieweg 1 NL-3641 RT Mijdrecht Tel: +31 297 280 666 |
|
Eesti Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
Norge Bayer AS Bayer HealthCare Animal Health Division Drammensveien 147 B NO-0277 Oslo Tlf: +47 24 11 18 00 |
|
EXláSa PROVET S.A. NiKq^ópou ®©Ká & Ay. Avapyóprov ©éon BpayKÓ EL-193 00 Aonpónupyog, Attik^ T@: +30 210 5575770-3 info@provet.gr |
Osterreich Bayer Austria GmbH Geschaftsbereich Tiergesundheit HerbststraBe 6 - 10 AT-1160 Wien Tel: +43 1 71146 2850 vet@bayer.at |
|
Espaňa Bayer Hispania, S.L. División Sanidad Animal Av. Baix Llobregat, 3-5 ES-08970 Sant Joan Despí (Barcelona) |
Polska Bayer Sp. z o.o. Animal Health Al. Jerozolimskie 158 PL-02-326 Warszawa |
|
Tel: +34 93 4956500 |
1 el: +48 22 5/2 35 00 |
|
France Bayer HealthCare Division Animal Health 13, rue Jean Jaures FR-92807 Puteaux Cedex Tél: +33 1 49 06 56 00 |
Portugal Bayer Portugal S.A. Divisao de Saúde Animal Rua da Quinta do Pinheiro, 5 PT-2794-003 Carnaxide Tel: +351 21 4172121 |
|
Hrvatska Bayer d.o.o. |
Románia |
|
Radnička cesta 80 HR-10000 Zagreb Tel: +385 1 65 99 935 bayer.veterina.registracije@bayer.com |
S.C. Bayer S.R.L. Sos. Pipera nr. 42, sector 2 Bucuresti 020112 - RO |
|
Tel: +40 21 529 5900 | |
|
Ireland Bayer Limited, Animal Health Division The Atrium, Blackthorn Road IE - Dublin 18 Tel: +353 1 2999313 |
Slovenija Bayer d.o.o. Bravničarjeva 13 SI-1000 Ljubljana Tel: +386 1 5814 400 |
|
Ísland Icepharma hf. Lynghálsi 13 IS-110 Reykjavík |
Slovenská republika Bayer s.r.o., Animal Health Siemensova 2717/4 |
|
Sími: +354 540 8000 |
CZ-155 00 Praha 5 Česká republika Tel: +420 2 66 10 14 71 |
|
Italia Bayer S.p.A. Viale Certosa, 130 IT-20156 Milano Tel: +39 02 3978 1 |
Suomi/Finland Orion Oyj ORION PHARMA ELÁINLÁÁKKEET Tengstrominkatu 8, PL/PB 425 FI-20101 Turku/Ábo Puh/Tel: +358 10 4261 |
|
Kúrcpog ACTIVET Ltd. Avxpéa Miaoú^n 50 CY-2415 'EyK^^n, AsuK^aía Tqk +357-22-591918 |
Sverige Bayer A/S, Bayer HealthCare Animal Health Division Arne Jacobsens Allé 13 DK-2300 Kopenhamn S Danmark Tel: +46 (0)8-580 223 00 |
|
Latvija Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
United Kingdom Bayer plc, Animal Health Division, Bayer House, Strawberry Hill, Newbury, Berkshire RG14 1JA-UK Tel: +44 1635 563000 |
PŘÍBALOVÁ INFORMACE PRO
Veraflox 25 mg/ml perorální suspenze pro kočky
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci: Bayer Animal Health GmbH D-51368 Leverkusen Německo
Výrobce odpovědný za uvolnění šarže: KVP Pharma +Veterinar Produkte GmbH Projensdorfer Str. 324 D-24106 Kiel Německo
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Veraflox 25 mg/ml perorální suspenze pro kočky pradofloxacinum
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Perorální suspenze s obsahem 25 mg/ml pradofloxacinum. Konzervační látka: kyselina sorbová (E200) 2 mg/ml Žlutavá až béžová suspense.
4. INDIKACE
Léčba:
• akutních infekcí horních cest dýchacích vyvolaných citlivými kmeny Pasteurella multocida, Escherichia coli a skupiny Staphylococcus intermedius (Včetně S. pseudintermedius).
• infekcí ran a abscesů vyvolaných citlivými kmeny Pasteurella multocida a skupiny Staphylococcus intermedius (včetně S. pseudintermedius).
5. KONTRAINDIKACE
Nepoužívejte u koček se známou přecitlivělostí na fluorochinolony.
Pro absenci dostupných informací se nedoporučuje podávat pradofloxacin u koťat mladších 6 týdnů.
Pradofloxacin nepoškozuje vývoj chrupavek u koťat ve věku 6 týdnů a starších. Avšak přípravek není vhodný pro kočky s přetrvávajícími lézemi kloubních chrupavek, protože během terapie fluorochinolony by mohlo dojít k jejich zhoršení.
Nepoužívejte u koček s poruchami centrálního nervového systému (CNS) jako je epilepsie, protože podávání fluorochinolonů může u predisponovaných zvířat pravděpodobně vyvolat záchvaty.
Nepoužívat u koček během březosti a laktace (viz část “Zvláštní upozornění“).
6. NEŽÁDOUCÍ ÚČINKY
Ve vzácných případech byly pozorovány mírné a přechodné trávící poruchy včetně zvracení.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
- velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
- časté (u více než 1, ale méně než 10 ze 100 zvířat)
- neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
- vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
- velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Kočky
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Perorální aplikace.
Dávkování
Doporučená dávka je 5 mg pradofloxacinu/kg živé hmotnosti jedenkrát denně. Vzhledem k stupnici na stříkačce je výsledné dávkování v rozmezí 5 mg až 7,5 mg/ kg ž. hm podle následující tabulky:
|
Živá hmotnost koček (kg) |
Dávka perorální suspenze k aplikaci (ml) |
Dávka pradofloxacinu (mg/kg ž.hm.) |
|
> 0,67 - 1 |
0,2 |
5 - 7,5 |
|
1 - 1,5 |
0,3 |
5 - 7,5 |
|
1,5 - 2 |
0,4 |
5 - 6,7 |
|
2 - 2,5 |
0,5 |
5 - 6,3 |
|
2,5 - 3 |
0,6 |
5 - 6 |
|
3 - 3,5 |
0,7 |
5 - 5,8 |
|
3,5 - 4 |
0,8 |
5 - 5,7 |
|
4 - 5 |
1 |
5 - 6,3 |
|
5 - 6 |
1,2 |
5 - 6 |
|
6 - 7 |
1,4 |
5 - 5,8 |
|
7 - 8 |
1,6 |
5 - 5,7 |
|
8 - 9 |
1,8 |
5 - 5,6 |
|
9 - 10 |
2 |
5 - 5,6 |
Doba léčby
Léčba by měla trvat tak dlouho, jak doporučil váš veterinární lékař. Délka terapie závisí na povaze a závažnosti infekce a jak léčba zabírá v případě vašeho zvířete. Pro většinu infekcí jsou doporučeny následující doby léčby:
|
Indikace |
Délka terapie (dny) |
|
Infekce ran a abscesy |
7 |
|
Akutní infekce horních cest dýchacích |
5 |
Poraďte se s Vaším veterinářem, pokud není pozorováno zlepšení stavu 3 dny od zahájení léčby.
9. POKYNY PRO SPRÁVNÉ PODÁVÁNÍ
Perorální suspenze by měla být podávána přímo do ústní dutiny, jak je zobrazeno:
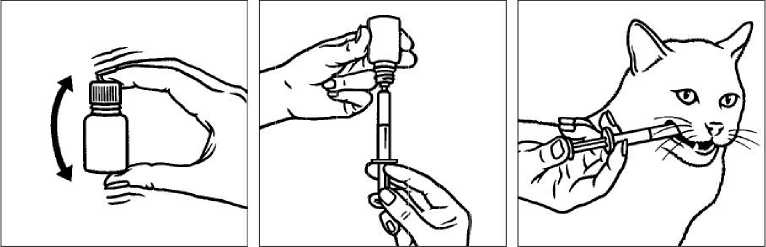
Před použitím dobře protřepejte.
Natáhněte příslušnou dávku do stříkačky.
Aplikujte přímo do dutiny ústní.
Z důvodu předcházení přenosu infekce, nepoužívejte jednu dávkovací stříkačku pro více zvířat. Jedna stříkačka by proto měla být použita pouze pro jedno zvíře. Po použití by měla být stříkačka opláchnuta čistou vodou a uchovávána spolu s lahvičkou v papírové krabičce.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávejte mimo dohled a dosah dětí.
Skladujte v originálním balení.
Udržujte lahvičku těsně uzavřenou.
Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnosti uvedené na etiketě. Doba použitelnosti po prvním otevření vnitřního obalu: 3 měsíce.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní opatření pro použití u zvířat:
Pokud je to možné, Veraflox by měl být používán pouze na základě výsledků testů citlivosti.
Při podávání přípravku je nutno zohlednit oficiální a místní antimikrobiální politiku.
Je vhodné využívat fluorochinolony pouze pro léčbu klinických onemocnění, které špatně odpovídají nebo u kterých se předpokládá, že budou špatně reagovat na léčbu jinými třídami antibiotik.
Použití přípravku v rozporu s pokyny uvedenými v SPC může zvýšit počet bakterií rezistentních na fluorochinolony a také snížit účinnost terapie ostatními fluorochinolony v důsledku zkřížené rezistence.
Pradofloxacin může zvýšit citlivost kůže na sluneční záření. Během terapie by proto zvířata neměla být vystavena nadměrnému slunečnímu záření.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům:
Vzhledem k možnému škodlivému účinku, musí být lahvičky a naplněné stříkačky uchovávány mimo dosah dětí.
Lidé se známou přecitlivělostí na chinolony by se měli vyvarovat kontaktu s tímto veterinárním léčivým přípravkem.
Zamezte kontaktu přípravku s kůží nebo očima. Umyjte si řádně ruce po použití přípravku.
V případě náhodného zasažení očí je okamžitě vypláchněte vodou.
V případě kontaktu s kůží opláchněte vodou.
Nejezte, nepijte a nekuřte při manipulaci s tímto veterinárním léčivým přípravkem.
V případě náhodného požití vyhledejte lékařskou pomoc a příbalovou informaci nebo etiketu produktu ukažte praktickému lékaři.
Březost, laktace a plodnost:
Bezpečnost tohoto veterinárního léčivého přípravku během březosti a laktace nebyla u koček stanovena.
Březost:
Nepoužívat během březosti. Pradofloxacin způsobil oční malformace při podávání potkanům ve fetálních a maternálních toxických dávkách.
Laktace:
Nepoužívat během laktace, protože nejsou k dispozici žádné údaje o použití pradofloxacinu u koťat mladších 6 měsíců. Je známo, že fluorochinolony přestupují přes placentu a dostávají se do mléka.
Plodnost:
Bylo prokázáno, že pradofloxacin nemá žádný účinek na plodnost u chovných zvířat.
Interakce s dalšími léčivými přípravky a další formy interakce:
Jsou některé léky, které by neměly být souběžně podávány vašemu zvířeti po dobu léčby, protože mohou způsobit vážné nežádoucí účinky. Sdělte Vašemu veterináři všechny léky, které máte v úmyslu podat zvířeti.
Veraflox by neměl být podáván společně s antacidy nebo sukralfátem (používané při žaludeční kyselosti), multivitaminy nebo mléčnými výrobky, jelikož může dojít k poklesu absorpce Verafloxu. Dále by Veraflox neměl být podáván v kombinaci s nesteroidními antiflogistiky (NSAIDs, používanými při léčbě bolesti, horečky nebo zánětu) zvířatům trpícím záchvaty z důvodu možného zvýšeného rizika záchvatu. Veraflox by neměl být současné podáván s teophylinem (používaný při chronických respiratorních onemocněních) nebo s digoxinem (používaný při kongestivním srdečním selhání) z důvodu možného zvýšení krevních hladin těchto léků, což může zvýšit účinek těchto léků.
Předávkování: (symptomy, první pomoc, antidota)
Při předávkování bylo pozorováno zvracení. Nejsou známa specifická antidota pradofloxacinu (nebo jiných fluorochinolonů), proto by v případě předávkování měla být podávána symptomatická léčba.
Tnkompatibility:
Vzhledem k chybějícím studiím o kompatibilitě, nesmí být tento veterinární léčivý přípravek podáván společně s jinými veterinárními léčivými přípravky.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z těchto přípravků, musí být likvidován podle místních právních předpisů.
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
Tato opatření napomáhají chránit životní prostředí.>
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku j sou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/
15. DALŠÍ INFORMACE
Veraflox perorální suspenze je dodávána ve 2 různých baleních:
- 15 ml lahvička a 3 ml perorální dávkovací stříkačka
- 30 ml lahvička
Na trhu nemusí být všechny velikosti balení.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien Bayer SA-NV J.E. Mommaertslaan 14 BE-1831 Diegem (Machelen) Tel/Tél: +32 2 535 66 54 |
Lietuva Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
|
Peny6^HKa Bt^rapnn Bt3pa^gaHe-KacHC OOfl 6yn. Etnrapna 102-4 BG ^OBen 5500 Ten: + 359 68 604 111 |
Luxembourg/Luxemburg Bayer SA-NV J.E. Mommaertslaan 14 BE-1831 Diegem (Machelen) Belgique/Belgien Tél/Tel: +32 2 535 66 54 |
|
Česká republika Bayer s.r.o., Animal Health Siemensova 2717/4 CZ-155 00 Praha 5 Tel: +420 2 66 10 14 71 |
Magyarország Bayer Hungária Kft. HU-1123 Budapest Alkotás u. 50 Tel: +36 1 487 4100 |
|
Danmark Bayer A/S, Bayer HealthCare |
Malta Bayer Animal Health GmbH |
|
Animal Health Division Arne Jacobsens Allé 13 DK-2300 Kobenhavn S Tlf: +45 4523 5000 |
DE-51368 Leverkusen Germany Tel: +49 2173 38 4012 |
|
Deutschland Bayer Vital GmbH Geschaftsbereich Tiergesundheit DE-51368 Leverkusen Tel: +49 214 301 |
Nederland Bayer B.V., Animal Health Division Energieweg 1 NL-3641 RT Mijdrecht Tel: +31 297 280 666 |
|
Eesti Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
Norge Bayer AS Bayer HealthCare Animal Health Division Drammensveien 147 B NO-0277 Oslo Tlf: +47 24 11 18 00 |
|
EXláSa PROVET S.A. NiKq^ópou ®©Ká & Ay. Avapyóprov ©éon BpayKÓ EL-193 00 Aonpónupyog, Attik^ T@: +30 210 5575770-3 info@provet.gr |
Osterreich Bayer Austria GmbH Geschaftsbereich Tiergesundheit HerbststraBe 6 - 10 AT-1160 Wien Tel: +43 1 71146 2850 vet@bayer.at |
|
Espaňa Bayer Hispania, S.L. División Sanidad Animal Av. Baix Llobregat, 3-5 ES-08970 Sant Joan Despí (Barcelona) |
Polska Bayer Sp. z o.o. Animal Health Al. Jerozolimskie 158 PL-02-326 Warszawa |
|
Tel: +34 93 4956500 |
Tel: +48 22 572 35 00 |
|
France Bayer HealthCare Division Animal Health 13, rue Jean Jaures FR-92807 Puteaux Cedex Tél: +33 1 49 06 56 00 |
Portugal Bayer Portugal S.A. Divisao de Saúde Animal Rua da Quinta do Pinheiro, 5 PT-2794-003 Carnaxide Tel: +351 21 4172121 |
|
Hrvatska Bayer d.o.o. |
Románia |
|
Radnička cesta 80 HR-10000 Zagreb Tel: +385 1 65 99 935 bayer.veterina.registracije@bayer.com |
S.C. Bayer S.R.L. Sos. Pipera nr. 42, sector 2 Bucuresti 020112 - RO |
|
Tel: +40 21 529 5900 | |
|
Ireland Bayer Limited, Animal Health Division The Atrium, Blackthorn Road IE - Dublin 18 Tel: +353 1 2999313 |
Slovenija Bayer d.o.o. Bravničarjeva 13 SI-1000 Ljubljana Tel: +386 1 5814 400 |
|
Ísland Icepharma hf. Lynghálsi 13 IS-110 Reykjavík Sími: +354 540 8000 |
Slovenská republika Bayer s.r.o., Animal Health Siemensova 2717/4 CZ-155 00 Praha 5 |
|
Česká republika Tel: +420 2 66 10 14 71 | |
|
Italia Bayer S.p.A. Viale Certosa, 130 IT-20156 Milano Tel: +39 02 3978 1 |
Suomi/Finland Orion Oyj ORION PHARMA ELÁINLÁÁKKEET Tengstrominkatu 8, PL/PB 425 FI-20101 Turku/Ábo Puh/Tel: +358 10 4261 |
|
Kúrcpog ACTIVET Ltd. Avxpéa Miaoú^n 50 CY-2415 'EyK^^n, AsuK^aía Tqk +357-22-591918 |
Sverige Bayer A/S, Bayer HealthCare Animal Health Division Arne Jacobsens Allé 13 DK-2300 Kopenhamn S Danmark Tel: +46 (0)8-580 223 00 |
|
Latvija Magnum Veterinaaria AS Vae 16 EE-76401 Laagri Tel: +372 650 1920 |
United Kingdom Bayer plc, Animal Health Division, Bayer House, Strawberry Hill, Newbury, Berkshire RG14 1JA-UK Tel: +44 1635 563000 |
58