Recuvyra 50 Mg/Ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA I
Recuvyra 50 mg/ml transdermální roztok pro psy
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Léčivá látka:
Fentanylum 50 mg/ml
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Transdermální roztok.
Čirý, bezbarvý až nažloutlý roztok.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi
4.2 Indikace s upřesněním pro cílový druh zvířat
Pro zmírnění pooperační bolesti spojené s velkými ortopedickými operacemi a operacemi měkkých tkání u psů.
4.3 Kontraindikace
Neaplikovat na kůži s porušenou rohovou vrstvou způsobenou zraněním či onemocněním.
Neaplikovat na jiná místa než na hřbet mezi lopatky.
Nepoužívat u psů s diagnózou srdečního selhání, hypotenzí, hypovolemií, hypoventilací, hypertenzí, epileptickou anamnézou, korneální patologií nesouvisející s věkem psa či u psů s podezřením na paralytický ileus.
Nepoužívat v případě přecitlivělosti na léčivou látku nebo na některou z pomocných látek.
Nepodávat druhou dávku veterinárního přípravku v průběhu následujících 7 dní. Akumulace fentanylu z důvodu opakovaného podání přípravku může způsobit vážné nežádoucí reakce včetně úmrtí. Nepodávejte více, než je doporučená dávka veterinárního léčivého přípravku.
Nedovolit psovi či jinému zvířeti olizovat místo aplikace, neboť biologická dostupnost přípravku po olizování je v prvních pěti minutách po aplikaci vysoká. Po dobu alespoň 72 hodin po aplikaci zamezit kontaktu místa aplikace s jinými zvířaty. Veterinární léčivý přípravek by neměl přijít do přímého kontaktu s ústní dutinou či sliznicí psů. Mírné vedlejší účinky jako sedace se mohou objevit po jednorázové ústní aplikaci fentanylu v množství více než 20 pg/kg (0,4 pl/kg přípravku Recuvyra). Vyšší perorální dávky mohou navodit anestetické účinky a kardiopulmonální depresi.
Nepoužívat veterinární léčivý přípravek u laktujících nebo březích fen, nebo u chovných zvířat (viz bod 4.7).
4.4 Zvláštní upozornění
Přípravek Recuvyra by se měl používat pouze u velkých chirurgických operací, které vyžadují opiátovou analgezii po dobu alespoň 4 dní.
Používejte pouze přiložené stříkačky. Použití jiných stříkaček či uchovávání veterinárního léčivého přípravku ve stříkačce může vést k nepřesnému dávkování. Nepoužívejte již použité stříkačky či aplikační hroty.
Veterinární léčivý přípravek je určen pro jednorázové podání 2 až 4 hodiny před chirurgickým zákrokem a zajišťuje analgezii na minimálně 4 dny. Má-li pes, kterému již byl tento veterinární léčivý přípravek aplikován, podstoupit další operaci, je nutné před aplikací další dávky zachovat 7denní dávkovací pauzu.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Tento veterinární léčivý přípravek je přísně určen pouze pro psy. Psi s hmotností vyšší než 20 kg by měli zůstat v hospitalizaci alespoň 48 hodin po aplikaci.
Opioidy včetně tohoto veterinárního léčivého přípravku mohou způsobovat snížení tělesné teploty, zpomalení dechové frekvence, snížení krevního tlaku či srdeční frekvence. Proto je nutné u psů během operační anestezie neustále sledovat teplotu v konečníku, tepovou, dechovou i srdeční frekvenci. Připraveno by mělo být i vybavení pro zajištění dýchání, ventilace s intermitentním pozitivním tlakem (IPPV) a přívod kyslíku.
Mezi další účinky, které mohou být pozorovány po podání fentanylu, zahrnují dysforii a zadržování moči, v těchto případech jsou na místě preventivní opatření.
Při dlouhotrvající sedaci po použití veterinárního léčivého přípravku může dojít k vysychání rohovky. Proto je vhodné před a po operaci aplikovat do oka lubrikaci a pokračovat tak, dokud pes nezačne sám opět mrkat.
Tento veterinární léčivý přípravek nesmí být použit u zvířat se systémovou chorobou.
U zvířat mladších 6 měsíců nebyla stanovena úroveň bezpečnosti tohoto veterinárního léčivého přípravku.
Před použitím tohoto přípravku se doporučuje zvážit dostupnost antagonisty opiátů, např. naloxonu, v případě potřeby rychlé úpravy stavu (viz body 4.6 a 4.10).
Psy nelze vydat zpět jejich majitelům, dokud se nezeslabí či nepomine pooperační sedace a dokud sami nepijí vodu a nepřijímají krmení v dostatečném množství, jež lze po dané operaci očekávat.
Psi, kteří jsou mírně utlumeni, sami nepijí a nepřijímají potravu, by měli podstoupit vyšetření kvůli případné dehydrataci a podání dodatečných tekutin a výživy v případě nutnosti. Stáze v gastrointestinálním traktu může způsobit vážné komplikace. Proto je nutné v případě nepřiměřené narkózy zvážit aplikaci antagonistů opiátů (viz bod 4.10).
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
Veterinární léčivý přípravek podávejte obezřetně. Vyhněte se kontaktu s pokožkou, neboť lidská kůže dokáže přípravek Recuvyra absorbovat. Tento veterinární léčivý přípravek může rovněž způsobit podráždění pokožky.
Při nakládání s veterinárním léčivým přípravkem by se měly používat osobní ochranné prostředky skládající se z latexových či nitrilových rukavic, ochrany očí a vhodného ochranného oděvu. Existuje-li riziko kontaktu s místem aplikace, je nutné použít vhodné ochranné rukavice.
Nepoužívat v blízkosti otevřeného ohně.
V případě náhodného potřísnění kůže oblast ihned opláchněte vodou, poté omyjte hojným množstvím mýdla a vody a vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
V případě náhodného potřísnění ochranného oděvu veterinárním léčivým přípravkem veškeré kontaminované kusy oděvu ihned svlékněte. Pomocí absorpčních materiálů, jako jsou papírové ubrousky, vysajte veškerý patrný roztok. Ubrousky ihned po použití odstraňte. Před dalším použitím veškeré kontaminované oděvy důkladně očistěte.
V případě náhodného kontaktu veterinárního léčivého přípravku s očima, oči vypláchněte hojným množstvím vody a ihned vyhledejte lékařskou pomoc.
V případě náhodného požití veterinárního léčivého přípravku vyhledejte ihned lékařskou pomoc. Pokud se po zasažení veterinárním léčivým přípravkem rozvinou příznaky jako zarudnutí pokožky, zmatenost, nauzea či zvracení, ihned vyhledejte lékařskou pomoc. Nejběžnější příznaky spojené
s předávkováním fentanylem u lidí zahrnují dechovou nedostatečnost, sedaci a miózu. Fentanyl ve vysokých dávkách způsobuje potenciálně smrtelnou dechovou nedostatečnost. Tuto nedostatečnost lze potlačit užitím vhodného přípravku na potlačení těchto účinků, např. naloxon.
Po aplikaci přípravku na psy se po dobu 5 minut vyhněte kontaktu s místem aplikace.
Z preventivních důvodů se nedoporučuje, aby přípravek RECUVYRA podávaly těhotné ženy. Tento přípravek smí podat pouze veterinární lékař.
Pro majitele psa
Po aplikaci je místo aplikace zaschlé a přímý kontakt s ním by neměl pro dospělé osoby představovat žádné riziko. U malých dětí (do 15 kg) by však mohl přímým kontaktem s místem aplikace dojít k závažnému vystavení účinkům fentanylu. Proto je nutné, aby ošetřovaní psi, jejichž živá hmotnost přesahuje 20 kg, zůstali po aplikaci přípravku 48 hodin v hospitalizaci. Z PREVENTIVNÍCH DŮVODŮ BY SE MALÉ DĚTI NEMĚLY PSA PO APLIKACI PŘÍPRAVKU RECUVYRA DOTKNOUT PO DOBU 72 HODIN (3 dnů).
Dotkne-li se malé dítě místa aplikace v průběhu 72 hodin po aplikaci přípravku, nesmí se část pokožky dítěte (např. prsty na ruce), kterou se psa dotklo, dostat do úst dítěte a musí být omyta mýdlem a vodou. Dotkne-li se dítě ústy místa aplikace v průběhu 72 hodin po aplikaci, je nutné ihned vyhledat lékařskou pomoc.
4.6 Nežádoucí účinky (frekvence a závažnost)
Fentanyl velmi často způsobuje u psů sedaci závislou na dávce, související s potenciálně nižším příjmem potravy a vody, sníženou produkcí stolice a přechodným úbytkem hmotnosti. Sedace může přetrvávat až 24 hodin po aplikaci.
Běžný je rovněž mírný pokles tělesné teploty a srdeční a dechové frekvence po dobu až 3 dnů po aplikaci. Běžnými vedlejšími účinky jsou zvracení a průjem. Ve vzácných případech byla také sledována dysforie a retence moči.
Během terénních testů 2 % psů, jimž byl aplikován tento veterinární léčivý přípravek, musela z důvodu vedlejších účinků opiátů dostat i antagonistu opiátů, naloxon. Viz bod 4.10.
Četnost nežádoucích účinků je charakterizována podle následujících pravidel:
• velmi časté (nežádoucí účinky se projevily u více než 1 z 10 zvířat v průběhu jednoho ošetření)
• časté (u více než 1, ale méně než 10 ze 100 zvířat)
• neobvyklé (u více než 1, ale méně než 10 z 1000 zvířat)
• vzácné (u více než 1, ale méně než 10 z 10000 zvířat)
• velmi vzácné (u méně než 1 z 10000 zvířat, včetně ojedinělých hlášení).
4.7 Použití v průběhu březosti, laktace nebo snášky
Březost a laktace:
Nebyla stanovena bezpečnost veterinárního léčivého přípravku pro použití během březosti a laktace. Nepoužívat veterinární léčivý přípravek u laktujících nebo březích fen, nebo u chovných zvířat.
Plodnost:
Laboratorní studie prováděné na krysách nesvědčí o teratogenních účincích přípravku ani o jiných negativních účincích na plodnost či embryonální/fetální vývoj.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Fentanyl je látka významně šetřící množství použitého anestetika. Abyste se vyhnuli předávkování u psů, kterým je tento veterinární léčivý přípravek podán, je nutné podat anestetikum, dokud není dosaženo požadovaného účinku.
Pokud se podává společně s morfinem či jinými opioidními typy analgetik, je nutné zachovat obezřetnost, neboť účinky ještě nebyly prostudovány.
Účinky přípravku v doprovodném užívání s a-adrenergickými agonisty nebyly studovány. Proto je u zvířat, jim byl podán tento veterinární léčivý přípravek, nutné zachovat při užívání a2-adrenergických agonistů zachovat obezřetnost z důvodu potenciálního zvýšeného nebo synergického účinku.
4.9 Podávané množství a způsob podání
Pro transdermální podání.
Jednorázová povrchová aplikace přípravku zajistí analgezii po dobu minimálně 4 dnů. Jakmile se aplikuje na kůži, veterinární léčivý přípravek rychle zasychá a fentanyl se perkutánně absorbuje do těla.
Doporučená dávka přípravku je 2,6 mg fentanylu/kg živé hmotnosti (tj. 0,052 ml/kg živé hmotnosti). Aplikuje se povrchově na hřbet mezi lopatky 2 až 4 hodiny před zákrokem a dle dávkovací tabulky uvedené níže.
Veterinární léčivý přípravek má úzké bezpečnostní rozpětí, a proto je důležité přesně odměřit jednotlivé dávky a vyhnout se předávkování. Nevystřikujte zbylé množství přípravku ve stříkačce či aplikačním hrotu, neboť toto je zohledněno v dávkovací tabulce. Na jedno místo na kůži lze nanést pouze 0,5 ml.
Na jedno místo na kůži naneste maximálně 0,5 ml přípravku, aniž byste pohnuli hrotem aplikátoru. Pokud je množství podávaného přípravku větší než 0,5 ml, posuňte hrot aplikátoru alespoň o 2,5 cm dál od prvního místa aplikace a znovu aplikujte maximálně 0,5 ml. Opakujte, dokud nenanesete veškeré vypočtené množství dávky.
Tento veterinární léčivý přípravek nesmí být v žádném případě aplikován na jiná místa na těle zvířete než do oblasti mezi lopatky, neboť absorpce tohoto přípravku se na různých místech pokožky těla liší. Tento přípravek smí podat pouze veterinární lékař.
Nepodávat druhou dávku veterinárního přípravku. Akumulace fentanylu z důvodu opakovaného podání přípravku může způsobit vážné nežádoucí reakce včetně úmrtí. Nepodávejte více, než je doporučená dávka veterinárního přípravku. Má-li pes, kterému již byl tento veterinární léčivý přípravek aplikován, podstoupit další operaci, je nutné před aplikací další dávky zachovat 7denní dávkovací pauzu.
|
Dávka (ml) |
Zívá hmotnost (kilogramy) |
|
0,2 |
3,0 až 4,2 |
|
0,3 |
4,3 až 6,1 |
|
0,4 |
6,2 až 8,0 |
|
0,5 |
8,1 až 9,9 |
|
0,6 |
10,0 až 11,7 |
|
0,7 |
11,8 až 13,6 |
|
0,8 |
13,7 až 15,5 |
|
0,9 |
15,6 až 17,4 |
|
1,0 |
17,5 až 19,3 |
|
1,1 |
19,4 až 21,2 |
|
1,2 |
21,3 až 23,1 |
|
1,3 |
23,2 až 25,0 |
|
1,4 |
25,1 až 26,9 |
|
1,5 |
27,0 až 28,8 |
|
1,6 |
28,9 až 30,6 |
|
1,7 |
30,7 až 32,5 |
|
1,8 |
32,6 až 34,4 |
|
1,9 |
34,5 až 36,3 |
|
2,0 |
36,4 až 38,2 |
|
2,1 |
38,3 až 40,1 |
|
2,2 |
40,2 až 42,0 |
|
2,3 |
42,1 až 43,9 |
|
2,4 |
44,0 až 45,8 |
|
2,5 |
45,9 až 47,7 |
|
2,6 |
47,8 až 49,6 |
|
2,7 |
49,7 až 51,4 |
|
2,8 |
51,5 až 53,3 |
|
2,9 |
53,4 až 55,2 |
|
3,0 |
55,3 až 57,0 |
Návod k použití:
Připevnění adaptéru (viz obr. 1):
1. Sejměte plastový ochranný obal z vršku skleněné lahvičky. Při nasazování adaptéru postavte lahvičku rovně na pevnou stabilní podložku.
2. Směřujte adaptér přímo na vršek lahvičky. Jemným, ale vyrovnaným tlakem zatlačte adaptér na lahvičku, dokud nezapadne. Jakmile zapadne, už adaptér nesundavejte. Lahvičku skladujte ve vertikální poloze s nasazeným adaptérem.
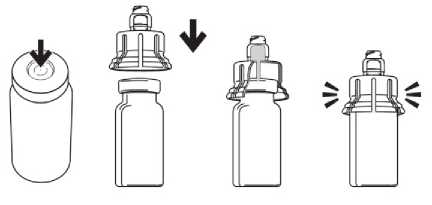
Obr. 1. Nasazení adaptéru Natahování roztoku z lahvičky (viz obr, 2):
1. Používejte pouze dodané stříkačky. Stříkačky jsou pouze na jednorázové použití.
2. K natažení roztoku z lahvičky natlačte hrot stříkačky do středu adaptéru a jemně stříkačkou otočte po směru hodinových ručiček přibližně o %, dokud pevně zapadne.
3. Otočte lahvičku vzhůru nohama a vytáhněte píst stříkačky, dokud nepojme požadované množství roztoku. V případě potřeby vytlačte vzduch zpět do lahvičky.
4. Abyste do stříkačky natáhli správné množství roztoku, musí kroužek na pístu stříkačky souhlasit se značkou na ampuli stříkačky.
5. Otočte lahvičku zpět do vertikální polohy, uchopte adaptér, otočte stříkačkou v protisměru hodinových ručiček o % a stříkačku vyjměte.
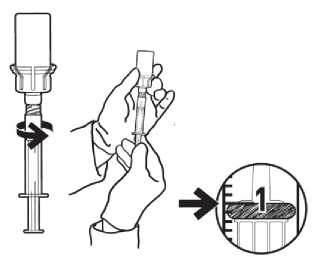
Obr. 2. Natažení roztoku z lahvičky Připevnění hrotu aplikátoru (viz obr. 3):
1. Otáčením hrotu aplikátoru po směru hodinových ručiček o 1/3 jej připevníte na stříkačku.
2. Hroty aplikátoru jsou na jedno použití. Otevřenou lahvičku skladujte ve vertikální poloze s připevněným adaptérem.
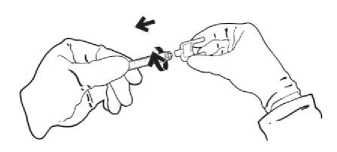
Obr. 3. Připevnění hrotu aplikátoru:
Příprava místa aplikace: V místě aplikace není nutné spínat srst zvířete. Nicméně, má-li pes velmi hustou srst, je vhodné chlupy před aplikací přípravku sepnout, aby byl zajištěn přímý kontakt veterinárního léčivého přípravku s kůží psa. Místo aplikace musí být čisté a bez jakýchkoliv povrchových látek.
Aplikace přípravku (viz obr. 4):
1. Položte hroty aplikátoru v přibližném úhlu 45° přímo na kůži v oblasti mezi lopatkami. Je důležité, aby se oba hroty přímo dotýkaly kůže.
2. Naneste na kůži maximálně 0,5 ml přípravku a pokuste se nepohnout aplikátorem. Pokud je množství podávaného přípravku větší než 0,5 ml, posuňte hrot aplikátoru alespoň o 2,5 cm dál od prvního místa aplikace a znovu aplikujte maximálně 0,5 ml. Opakujte, dokud nenanesete veškeré vypočtené množství dávky.
3. Držte psa pod kontrolou přibližně 2 minuty a zamezte jakémukoliv kontaktu s místem aplikace po dobu 5 minut, aby roztok mohl zcela zaschnout.
4. Nevystřikujte zbylé množství přípravku ve stříkačce či aplikačním hrotu, neboť toto je zohledněno v dávkovací tabulce.
5. Odhoďte použitou stříkačku/hrot aplikátoru v jednom do příslušného kontejneru.

Obr 4. Aplikace přípravku
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
V případě, že po aplikaci/předávkování veterinárním léčivým přípravkem vypozorujete některý z následujících účinků, zahajte reverzní léčbu: těžká sedace, bezvědomí, záchvaty, obtížné či břišní dýchání či těžká hypotenze.
Nadměrné předávkování může vést k ledvinovému selhání díky hypotenzi způsobené
gastrointestinální hypomobilitou.
Podáním naloxonu v množství 0,04 mg/kg můžete odvrátit nežádoucí reakce spojené s povrchovým podáním fentanylu. Ke zlepšení stavu by mělo dojít rychle během 1 až 2 minut. Trvání účinku naloxonu se u psa pohybuje mezi 45 minutami a 3 hodinami. Účinky transdermální aplikace fentanylu by mohly trvat déle než účinky antagonisty opioidů. Je-li potřeba, podejte další dávku naloxonu.
Psi, kteří jsou mírně utlumeni, sami nepijí a nepřijímají potravu v dostatečném množství nutném pro zachování vhodného předoperačního stavu, by měli podstoupit vyšetření kvůli případné dehydrataci a podání dodatečných tekutin a výživy v případě nutnosti.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina: Analgetikum, opioid, derivát fenylpiperidinu.
ATCvet kóde: QN02AB03
5.1 Farmakodynamické vlastnosti
Fentanyl vyvolává analgetické účinky navázáním se a aktivací p (mu) opioidních receptorů, které se převážně nachází v částech, jež regulují bolest v mozku a v míše. Analgetické účinky veterinárního léčivého přípravku jsou závislé na výsledné koncentrace fentanylu v krvi dosažené po aplikaci.
5.2 Farmakokinetické údaje
Průměrná koncentrace fentanylu v plazmě od času 0 do 96 hodin po podání dávky je přibližně 1,32 ng/ml. Rozsahy (90% interval) farmakokinetických parametrů u psů jsou uvedeny níže:
|
Konečný biologický poločas (hod) |
Cas do dosažení koncentrace 1,0 ng/ml (hod) |
Cmax (ng/ml) |
tmax (hod) |
tlag (hod) |
|
68,7 - 79,8 |
1,3 - Nebylo Dosaženo |
0,7 - 4,7 |
10,3 - 17,9 |
0,4 - 0,8 |
Po aplikaci přípravku na kůži se fentanyl rychle absorbuje do pokožky. V okamžiku zaschnutí, přibližně 2 až 5 minut po aplikaci, se již do rohovité vrstvy kůže absorbuje fentanyl a oktisalátu. Během následujících dní pak fentanyl proniká ze stratum corneum (rohové vrstvy kůže) do dalších vrstev a do velkého krevního oběhu. Maximální koncentrace fentanylu v plazmě, 0,7 až 4,7 ng/ml, je dosaženo 10 až 18hodin po aplikaci dávky. U více než 60 % psů během 4 hodin po podání přípravku dosahují hodnoty plazmatické koncentrace fentanylu 1,0 ng/ml, (což je množství, které se obecně považuje za analgetické). Systémová biologická dostupnost veterinárního léčivého přípravku je přibližně 40 %. Farmakokinetický profil veterinárního léčivého přípravku je primárně charakterizován dlouhodobou systémovou absorpcí. Fentanyl je vysoce rozpustný v lipidech a u psů se rychle šíří do různých tkání a prostupuje hematoencefalickou bariérou. Vyvazování fentanylu na plazmatické proteiny u psů se odhaduje na 60 %.
Fentanyl je rychle metabolizován a vyloučen v moči. Clearance fentanylu se u psů pohybuje od 1,7 do 4,7 l/h/kg.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Oktisalát
Isopropylalkohol
6.2 Inkompatibility
Nejsou známy.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky Doba použitelnosti po prvním otevření injekční lahvičky: 30 dní
6.4 Zvláštní opatření pro uchovávání
Neotevřená injekční lahvička nevyžaduje žádné zvláštní podmínky k uchovávání. Neuchovávejte ani nepoužívejte v blízkosti otevřeného ohně.
Otevřenou injekční lahvičku s adaptérem uchovávejte ve vertikální poloze. Uchovávejte injekční lahvičku společně se souhrnem údajů o přípravku.
Po 1. otevření obalu stanovte datum likvidace zbylého množství přípravku v obalu a to na základě doby použitelnosti po prvním otevření uvedené v této příbalové informaci. Toto datum napište na místo k tomu určené na etiketě.
6.5 Druh a složení vnitřního obalu
Injekční lahvička:
Jantarově žlutá skleněná lahvička typu I obsahující 10 ml roztoku, uzavřena šedou butylovou gumovou zátkou a dvojdílnou hliníkovou pertlí s šedým plastovým flip-off odtrhovacím víčkem.
Dávkovač:
• Polykarbonátový adaptér na injekční lahvičky Robertsite (umožňující luerové spojení s lahvičkou bez nutnosti jehly).
• Dvojhrotý polykarbonátový aplikátor.
• 3ml polypropylenová stříkačka se silikonovým kroužkem v pístu.
Každé balení se dodává s jedním adaptérem na lahvičku, 15 stříkačkami, 15 hroty aplikátoru, 15 příbalovými informacemi pro majitele zvířete a s jedním souhrnem údajů o přípravku (pro veterinárního lékaře)
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo
odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly & Company Ltd Elanco Animal Health Lilly House Priestley Road Basingstoke,
Hampshire RG24 9NL Spojené království.
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/11/127/001
9. DATUM REGISTRACE/ PRODLOUŽENÍ REGISTRACE
{06/10/2011}
10. DATUM REVIZE TEXTU
{MM/RRRR}
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury (EMEA) http://www.ema.europa.eu/ema/
ZÁKAZ PRODEJE, VÝDEJE A/NEBO POUŽITÍ
PŘÍLOHA II
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
C. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE BEZPEČNÉHO A ÚČINNÉHO POUŽITÍ
D. DEKLARACE HODNOT MRL
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce odpovědného za uvolnění šarže:
McGregor Cory Cherwell 2 Middleton Close
Banbury, Oxfordshire, OX16 4RS Spojené království.
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
C. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE BEZPEČNÉHO A ÚČINNÉHO POUŽITÍ
Pro účely zajištění bezpečnosti nového druhu výrobku a vyloučení nejistot týkajících se případných interakcí současně podaných léčiv během operace a v pooperačním období, zajistí držitel rozhodnutí o registraci sběr a hodnocení detailních údajů o klinické bezpečnosti výrobku na reprezentativním vzorku psů, jimž byl přípravek aplikován. Tyto údaje pak budou předány agentuře společně s periodicky aktualizovanými zprávami o bezpečnosti přípravky.
D. DEKLARACE HODNOT MRL
Neuplatňuje se.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
Recuvyra 50 mg/ml transdermální roztok pro psy. Fentanylum
Fentanylum 50 mg/ml
Transdermální roztok
1 lahvička (10 ml)
1 adaptér na lahvičku 15 stříkaček 15 hrotů aplikátoru
Psi
Pro zmírnění pooperační bolesti spojené s velkými ortopedickými operacemi a operacemi měkkých tkání u psů.
Pro transdermální podání.
Před použitím čtěte souhrn údajů o přípravku.
Není určeno pro potravinová zvířata.
Náhodné podání je nebezpečné - před použitím čtěte souhrn údajů o přípravku
EXP: {MM/RRRR}
Po 1. otevření spotřebujte do 30 dnů.
Otevřenou lahvičku s adaptérem uchovávejte ve vertikální poloze.
Odpad likvidujte podle místních právních předpisů.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA
Pouze pro zvířata - veterinární léčivý přípravek je vydáván pouze na předpis.
Uchovávat mimo dosah dětí.
Eli Lilly & Company Ltd Elanco Animal Health Lilly House Priestley Road Basingstoke,
Hampshire RG24 9NL Spojené království
EU/2/11/127/001
Č.š.:> {číslo}
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU MALÉ VELIKOSTI {etiketa injekční lahvičky}_
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Recuvyra 50 mg/ml transdermální roztok pro psy. Fentanylum
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTK Y (EK)
Fentanylum 50 mg/ml
3. OBSAH VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
10 ml
4. CESTA(Y) PODÁNÍ
Pro transdermální podání.
Souhrn údajů o přípravku uchovávat společně s lahvičkou a přečíst před použitím
5. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
6. ČÍSLO ŠARŽE
Č.š.: {číslo}
7. DATUM EXSPIRACE
EXP: {MM/RRRR}
Po 1. otevření spotřebujte do...
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
Recuvyra 50 mg/ml transdermální roztok pro psy
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Eli Lilly & Company Ltd Elanco Animal Health Lilly House Priestley Road Basingstoke,
Hampshire RG24 9NL Spojené království
Výrobce odpovědný za uvolnění šarže:
McGregor Cory Cherwell 2 Middleton Close
Banbury, Oxfordshire, OX16 4RS Spojené království
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
Recuvyra 50 mg/ml transdermální roztok pro psy
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Recuvyra je čirý, bezbarvý až nažloutlý roztok, který obsahuje 50 mg Fentanylum (léčivá látka) na ml roztoku. Přípravek Recuvyra rovněž obsahuje oktisalát a isopropylalkohol. Přípravek Recuvyra je dodáván vašemu veterináři v lahvičce z jantarového skla s obsahem 10 ml přípravku.
4. INDIKACE
Recuvyra zmírňuje pooperační bolesti spojené s velkými ortopedickými operacemi a operacemi měkkých tkání u psů.
5. KONTRAINDIKACE
Vašemu psovi by neměl být aplikován přípravek Recuvyra, pokud:
• Má porušenou, poškozenou nebo nemocnou pokožku v místě aplikace.
• Prodělal srdeční selhání, trpí na nízký či vysoký krevní tlak, špatně dýchá, prodělal v minulosti epilepsii, trpí korneální patologií nesouvisející s věkem či má nebo může mít částečný či úplný paralytický ileus.
• Má alergii na léčivou látku (fentanyl) nebo na některou z pomocných látek.
• Laktuje, je březí nebo jde o chovného psa.
Přípravek Recuvyra smí podávat pouze váš veterinární lékař:
• Pouze v jediné dávce dle doporučeného dávkování
• Pouze mezi lopatky vašeho psa a nikoliv jinam.
• Pouze jedinkrát. Druhou dávku přípravku Recuvyra lze podat až po uplynutí 7denní pauzy.
Je důležité, abyste po dobu alespoň 3 dnů (72 hodin) po aplikaci nedovolili jiným psům či domácím mazlíčkům olizovat či jinak přijít do kontaktu s místem aplikace mezi lopatkami vašeho psa, kam veterinář aplikoval přípravek Recuvyra, neboť by jinak mohlo dojít u těchto zvířat k nežádoucím účinkům.
6. NEŽÁDOUCÍ ÚČINKY
Jako jakýkoliv jiný lék může přípravek Recuvyra způsobit nežádoucí účinky. Váš veterinář vám je může nejlépe všechny popsat. Může dojít k:
Velmi běžné (tj. u více než 10 % psů, jimž byl přípravek aplikován)
• Lehká sedace (ospalost) po dobu až 24 hodin po aplikaci přípravku Recuvyra vaším veterinářem.
• Ztráta chuti k j ídlu a snížení příj mu vody.
• Snížená produkce stolice a dočasný úbytek hmotnosti
Běžné (tj. u 1 až 10 % psů, jimž byl přípravek aplikován)
• Pocit nižší tělesné teploty na dotyk (např. uši).
• Snížení srdeční i dechové frekvence.
• Zvracení a průjem.
Vzácné (tj. u 0,01 až 0,1 % psů, jimž byl přípravek aplikován)
• Dysforie, retence moči
Shora uvedené vedlejší účinky se mohou objevit v průběhu 3 dnů (72 hodin) po aplikaci přípravku
Recuvyra.
Bude-li to nutné, může vás veterinář nasadit vašemu psu vhodnou léčbu (například antagonistu nazývaného naloxon, jehož nástup účinků je velmi rychlý, 1 - 2 minuty). V případě potřeby může veterinář podat psovi i více než jednu dávku naloxonu.
Je-li vás pes více než jen mírně utlumený, přijímá méně potravy anebo méně pije, poraďte se s vaším veterinárním lékařem.
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Recuvyra je roztok určený k opatrné aplikaci na pokožku psa provedené pouze veterinárním lékařem. Dvě až čtyři hodiny před operací se psovi aplikuje doporučená dávka přípravku Recuvyra (2,6 mg fentanylu / kg živé hmotnosti) přímo na kůže mezi lopatky. Během 5 minut přípravek na kůži zaschne. Fentanyl se dále postupně vstřebává do krevního oběhu psa a přináší úlevu od bolesti. Jedna dávka uleví od bolesti na dobu minimálně 4 dní.
Váží-li váš pes více než 20 kg, zůstane hospitalizován na klinice minimálně 48 hodin po aplikaci
přípravku Recuvyra. Aplikace přípravku Recuvyra nezpůsobí vašemu psovi žádnou bolest. Váš veterinář při aplikaci přípravku na pokožku psa použije dávkovací tabulku a speciálně navržený aplikátor bez použití j akýchkoliv j ehel.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Recuvyra je roztok určený k podání na pokožku hřbetu mezi lopatky (viz obrázek níže) provedenému pouze veterinárním lékařem pomocí speciálně navrženého aplikátoru na jedno použití bez potřeby jehel. Jestliže váš pes nemá hustou srst, pak není nutné chlupy v místě aplikace, tj. mezi lopatkami psa, spínat či holit.

10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Jelikož přípravek Recuvyra obsahuje fentanyl (léčivá látka), lze jej uchovávat zabezpečený pouze v ordinaci veterinárního lékaře. Váš veterinář zajistí, aby byl přípravek řádně a bezpečně skladován po dobu až 3 let. Obsah lahvičky je však nutné spotřebovat do 30 dnů po odebrání první dávky.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Přípravek Recuvyra je určen pouze pro psy.
Nepoužívat přípravek Recuvyra, pokud je vaše fena březí, kojí nebo jde o chovné zvíře, anebo se jedná štěně mladší než 6 měsíců. Vztahuje-li se některá z těchto podmínek na vašeho psa, informujte o tom vašeho veterinárního lékaře ještě před ošetřením.
Sdělte svému veterináři, je-li váš pes nemocný nebo byl v nedávné době nemocný, zda někdy měl potíže s dýcháním, srdcem či krevním tlakem, trpí epilepsií, měl zažívací potíže, problémy s ledvinami či zrakem a jaké léky bral, zejména pokud onemocnění proběhlo během posledního měsíce.
Jakmile veterinář aplikuje přípravek Recuvyra, bude následně pečlivě sledovat vašeho psa, zda správně reaguje.
Váš pes bude moci s vámi odejít domů pouze v případě, že se zcela zotaví z operace, bude normálně pít i přijímat potravu.
Psi s hmotností 20 kg a více zůstanou hospitalizováni na klinice minimálně 48 hodin po aplikaci přípravku Recuvyra.
Pokud váš veterinář kombinuje přípravek Recuvyra s jinými morfinovými či opioidními analgetiky anebo s a-adrenergickými agonisty, měl by postupovat obezřetně, neboť možné vedlejší účinky kombinované léčby ještě nebyly prostudovány. Při používání přípravku Recuvyra by váš veterinář měl podávat méně anestetik a pouze pro účely dosažení požadovaného výsledku.
Po aplikaci je místo aplikace zaschlé a přímý kontakt s ním by neměl pro dospělé osoby představovat
žádné riziko. U dětí však může přímým kontaktem s místem aplikace dojít k závažnému vystavení účinkům fentanylu. Proto je nutné, aby lidé, jejichž psům byl přípravek Recuvyra aplikován, podnikli příslušná zvláštní opatření.
MALÉ DĚTI BY SE NEMĚLY PSA PO APLIKACI PŘÍPRAVKU RECUVYRA DOTKNOUT PO DOBU 72 HODIN (3 dnů). Dotkne-li se malé dítě místa aplikace v průběhu 72 hodin po aplikaci přípravku, nesmí se část pokožky dítěte (např. prsty na ruce), kterou se psa dotklo, dostat do úst dítěte a musí být omyta mýdlem a vodou. Dotkne-li se dítě ústy místa aplikace v průběhu 72 hodin po aplikaci, je nutné ihned vyhledat lékařskou pomoc.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Veškerý nepoužitý veterinární léčivý přípravek či odpad z tohoto veterinárního přípravku likvidujte podle místních právních předpisů.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury (EMEA) http://www.emea.europa.eu/.
15. DALŠÍ INFORMACE
Přípravek Recuvyra je silné analgetikum s dlouhodobým účinkem. Měl by se používat pouze u velkých chirurgických operací, které vyžadují opiátovou analgezii po dobu alespoň 4 dní.
Má-li pes, kterému již byl tento veterinární léčivý přípravek aplikován, podstoupit další operaci, je nutné před aplikací další dávky zachovat 7denní dávkovací pauzu.
Váš veterinář obdržel zvláštní informační list (souhrn údajů o přípravku) s více detaily o správné a bezpečné aplikaci přípravku Recuvyra.
Abyste si lépe zapamatovali, kdy byl vašemu psu aplikován přípravek Recuvyra a jak dlouho je nutné zabránit kontaktu dítěte s místem aplikace na hřbetě vašeho psa, vám poslouží tabulka níže, kam veterinář poznačí datum aplikace. Uschovejte tuto příbalovou informaci na bezpečném místě.
|
Tento pes byl léčen: Datum |
Čas |
|
Děti se mohou psa dotýkat od: Datum |
Čas |
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím příslušného místního zástupce držitele rozhodnutí o registraci.
|
Belgie/Belgique/Belgien (Belgium) Eli Lilly Benelux Stoofstraat 52 B-1000 Brussels Tel.: +32 2 548 8484 Belgium |
Luxembourg/Luxemburg Eli Lilly Benelux Stoofstraat 52 B-1000 Brussels Tel.: +32 2 548 8484 Belgium |
|
Peny6^HKa Bt^rapnn Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
Magyarország Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
|
Česká republika (Czech republic) Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
Malta Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
|
Danmark (Denmark) Elanco Animal Health A/S Lysk^r 3 E, 2 t.v. 2730 Herlev Tel.: + 45 45 26 6060 Denmark |
Nederland (the Netherlands) Eli Lilly Nederland B.V. Elanco Animal Health Grootslag 1-5 NL-3991 RA Houten Tel.: +31 30 602 59 55 The Netherlands |
|
Deutschland Lilly Deutschland GmbH Abteilung Elanco Animal Health Werner-Reimers-Str 2-4 61352 Bad Homburg Tel: +49 6172 273 2964 Germany |
Norge (Norway) Elanco Animal Health A/S Lysk^r 3 E, 2 t.v. 2730 Herlev Tel.: +45 45 26 6060 Denmark |
|
Eesti Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
Osterreich (Austria) Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
|
EXláda Eli Lilly Regional Operations GmbH Elanco Animal Health Kolblgasse 8-10 A-1030 Wien Tel.: +43 1 711 78 0 Austria |
Polska (Poland) Eli Lilly Polska Sp. z o.o. ul. Žwirki i Wigury 18a 02-092 Warszawa Tel.: +48 22 440 33 00 Poland |
Espaňa (Spain)
Elanco Valquimica S.A.
Avda. de la Industria, 30 E-28108 Alcobendas (Madrid) Tel.: +34 91 663 5000 Spain
Finland (Finland)
Elanco Animal Health A/S Lysk^r 3 E, 2 t.v.
2730 Herlev
Tel.: +45 45 26 6060
Denmark
France (France)
Lilly France S.A.S.
Elanco Santé Animale 24 Boulevard Vital Bouhot 92200 Neuilly sur Seine Paris
Tel. : +33/(0) 1 55 49 35 29 France e
Ireland (Ireland)
Eli Lilly & Company Ltd.
Elanco Animal Health Priestley Road
Basingstoke
Hampshire RG24 9NL
Tel.: +44 1256 35 31 31
United Kingdom
Island (Iceland)
Elanco Animal Health A/S Lysk^r 3 E, 2 t.v.
2730 Herlev
Tel.: +45 45 26 60 60
Denmark
Italia (Italy)
Eli Lilly Italia S.p.A Via Gramsci, 731- 733 SestoFiorentino I-50019 Firenze Tel.: +39 0 55 42 57031 Italy
Kórcpog
Eli Lilly Regional Operations GmbH
Elanco Animal Health
Kolblgasse 8-10
A-1030 Wien
Tel.: +43 1 711 78 0
Austria
Portugal (Portugal)
Lilly Portugal - Produtos
Farmaceuticos, Lda. Torre Ocidente
Rua Galileu Galilei, N°2 Piso 7
Fracqao A/D
1500 - 392 LISBOA
Portugal
Románia
Eli Lilly Romania SRL Str. Menuetului nr. 12 Cladirea D, et 2, 013713, sector 1, Bucuresti, Tel: +40-21-4023000, fax: +40-21-4023001 Romania
Slovenija (Slovenia)
Eli Lilly Regional Operations GmbH
Elanco Animal Health
Kolblgasse 8-10
A-1030 Wien
Tel.: +43 1 711 78 0
Austria
Slovenská republika (Slovak Republic)
Eli Lilly Regional Operations GmbH
Elanco Animal Health
Kolblgasse 8-10
A-1030 Wien
Tel.: +43 1 711 78 0
Austria
Sverige (Sweden)
Elanco Animal Health A/S Lysk^r 3 E, 2 t.v.
2730 Herlev
Tel.: + 45 45 26 60 60
Denmark
United Kingdom
Eli Lilly & Company Ltd Elanco Animal Health Priestley Road; Basingstoke Hampshire RG24 9NL Tel.: + 44 1256 35 31 31 United Kingdom
Lietuva (Lithuania)
Eli Lilly Regional Operations GmbH
Elanco Animal Health
Kolblgasse 8-10
A-1030 Wien
Tel.: +43 1 711 78 0
Austria
Latvija (Latvia)
Eli Lilly Regional Operations GmbH
Elanco Animal Health
Kolblgasse 8-10
A-1030 Wien
Tel.: +43 1 711 78 0
Austria
Hrvatska (Croatia)
Eli Lilly Regional Operations GmbH
Elanco Animal Health
Kolblgasse 8-10
A-1030 Wien
Tel.: +43 1 711 78 0
Austria
26