Osurnia
SOUHRN ÚDAJŮ O PŘÍPRAVKU
PŘÍLOHA 1
OSURNIA ušní gel pro psy
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Léčivé látky:
1 dávka (1,2 g) obsahuje:
10 mg 10 mg 1 mg 0,9 mg
1 mg
Terbinafin (terbinafinum)
Florfenicol (florfenicolum)
Betametazon acetát(betamethasoni acetas) odpovídá betametazonové báze
Pomocná látka:
Butylhydroxytoluen (E321)
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Ušní gel.
Krémově bílý až světle žlutý průsvitný gel.
4. KLINICKÉ ÚDAJE
4.1 Cílové druhy zvířat
Psi.
4.2 Indikace s upřesněním pro cílový druh zvířat

zvukovodu souvisejících se Staphylococcus pseudintermedius aMalasseziapachydermatis.
4.3 Kontraindikace
Nepoužívat v případě přecitlivělosti na léčivé látky, na ostatní kortikosteroidy nebo na některou z pomocných látek.
Nepoužívat, pokud je ušní bubínek perforovaný.
Nepoužívat u psů s generalizovanou demodikózou.
Nepoužívat u březích nebo chovných zvířat.
4.4 Zvláštní upozornění pro každý cílový druh
Bakteriální a plísňový zánět vnějšího zvukovodu je často sekundárním projevem jiných onemocnění.Před zvážením antibakteriální léčbyby se měla stanovit příslušná diagnóza a léčbakauzativních potíží.
Vyčistěte uši před úvodní aplikací přípravku. Čištění uší by se nemělo opakovat dříve než za 21 dní po druhé aplikaci. V klinických zkouškách se na čištění uší používal pouze fyziologický roztok.
Je možné pozorovat přechodné zvlhčení vnitřní a vnější strany ušního boltce. Tento nález lze přisoudit přítomnosti přípravku a není důvodem ke klinickým obavám.
4.5 Zvláštní opatření pro použití
Zvláštní opatření pro použití u zvířat
Pokud se objeví přecitlivělost na jakoukoliv složku, ucho by se mělo důkladně vypláchnout. Bezpečnost přípravku nebyla stanovena u psů mladších než 2 měsíce nebo o hmotnosti nižší než 1,4 kg-
Kdykoliv je to možné, použití veterinárního léčivého přípravku by mělo být založeno na identifikaci infekčních organismů a výsledku testu citlivosti.
Použití veterinárního léčivého přípravku, které je odlišné od pokynů uvedených v tomto souhrnu údajů o přípravku (SPC), může zvýšit prevalenci bakterií rezistentních na florfenikol a plísní rezistentních na terbinafin, a snížit účinnost léčby jinými antibiotiky a antimykotiky.
V případě zánětu zvukovodu vyvolaného parazity aplikujte vhodnou akaricidní léčbu.
Před aplikací veterinárního léčivého přípravku je třeba důkladně vyšetřit vnější zvukovod, zda není perforovaný ušní bubínek.
Je známo, že dlouhodobé a intenzivní použití povrchově podávaných kortikosteroidů vyvolává systémové účinky, včetně suprese funkce nadledvinek (viz bod 4.10).
Ve studiích snášenlivosti (před a po stimulaci ACTH) bylo pozorováno po aplikaci přípravku snížení hladiny kortizolu, což naznačuje, že se betamethason vstřebává a vstupuje do systémové cirkulace. Toto zjištění nebylo v korelaci s patologickými, nebo klinickými příznaky a bylo reverzibilní.
Je třeba se vyhnout další léčbě kortikosteroidy.
Používejte obezřetně u psů s podezřením na onemocnění endokrinního systému, nebo pokud se takové onemocnění prokáže (tj. diabetes mellitus, hypotyreóza nebo hypertyreóza atd.).
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům
V případě náhodného kontaktu s očima je důkladně vypláchněte vodou.
V případě náhodného kontaktu s kůží důkladně opláchněte potřísněnou kůži vodou.
V případě náhodného pozření vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
4.6 Nežádoucí účinky (frekvence a závažnost)
U psů se zánětem vnějšího zvukovodu nebyly v terénních podmínkách po podání tohoto veterinárního léčivého přípravku podle bodu 4.9 pozorovány žádné nežádoucí účinky.
4.7 Použití v průběhu březosti a laktace
Je známo, že betamethason je u laboratorních druhů zvířat teratogenní. Nebyla stanovena bezpečnost veterinárního léčivého přípravku u březích a laktujících fen, proto by přípravek neměl být používán během březosti a laktace.
Plodnost
Nepoužívat u chovných zvířat.
4.8 Interakce s dalšími léčivými přípravky a další formy interakce
Vyjma fyziologického roztoku nebyla prokázána kompatibilita s jinými přípravky na čištění uší.
4.9 Podávané množství a způsob podání Ušní podání.
Podávejte jednu tubu na jedno infikované ucho. Opakujte aplikaci po 7 dnech.
Maximální klinická odezva nemusí být viditelná až do 21 dní po druhé aplikaci.
Pokyny pro správné použití:
Před prvním podáním přípravku se doporučuje vnější zvukovod vyčistit a vysušit.Nedoporučuje se opakovat čištění ucha po dobu 21 dnů po druhé aplikaci přípravku. Pokud je léčba tímto přípravkem přerušena, zvukovody by se měly vyčistit před zahájením léčby alternativním přípravkem.
1. Otevřete tubu otočením měkké špičky.
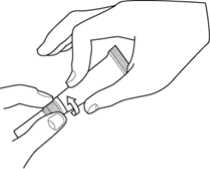
2. Zaveďte tuto pružnou měkkou špičku do zvukovodu.
3. Aplikuje přípravek do zvukovodu stlačením tuby mezi dvěma prsty.
4. Po aplikaci je možné dolní část ucha krátce a jemně promasírovat k usnadnění rovnoměrné distribuce veterinárního léčivého přípravku do zvukovodu.
Uchovávat mimo dosah dětí.
4.10 Předávkování (symptomy, první pomoc, antidota), pokud je to nutné
U psů kříženců vážících 10 až 14 kg vedla aplikace pětinásobku doporučené dávky do ucha jednou týdně během 5 po sobě jdoucích týdnů (celkem šest aplikací 5 tub na jedno ucho nebo 10 tub na jednoho psa) ke klinickým příznakům zvlhčení vnitřní a vnější části ušního boltce (což bylo přisuzováno přítomnosti přípravku). Při ACTH stimulačním testu se neobjevily žádné klinické příznaky související s unilaterální tvorbou váčků v epitelu membrány bubínku (také pozorováno po šesti aplikacích jednou týdně při použití 1 tuby na jedno ucho nebo 2 tub na jednoho psa), unilaterální mukózní ulcerace povlaku dutiny středního ucha nebo snížení kortizolové odpovědi v séru pod normální referenční úroveň. Snížení hmotnosti nadledvinek a brzlíku doprovázené atrofií kůry nadledvinek a lymfoidní deplecí brzlíku souvisely se sníženými hladinami kortizolu a souhlasily a s farmakologickými účinky betamethasonu. Tyto nálezy byly považovány za vratné. Vratnost tvorby puchýřků na epiteliální bubínkové membráně je také pravděpodobně způsobená epiteliální migrací, což je mechanismus přirozeného čištění a sebeobnovení membrány bubínku a zvukovodu.Kromě toho byl u psů prokázán mírně zvýšený počet červených krvinek, hematokrit, celkový protein, albumin a alaninaminotransferáza. Tyto nálezy nebyly spojeny s klinickými příznaky.
4.11 Ochranné lhůty
Není určeno pro potravinová zvířata.
5. FARMAKOLOGICKÉ VLASTNOSTI
Farmakoterapeutická skupina:otologika - kortikosteroidy a antiinfektiva v kombinaci ATCvet kód:QS02CA90
5.1 Farmakodynamické vlastnosti
Tento přípravek je fixní kombinací tří léčivých látek (kortikosteroidu, antimykotika a antibiotika): Betamethason acetát patří do diesterové třídy glukokortikosteroidů se silnou přirozenou glukokortikoidovou aktivitou, která zklidňuje jak zánět, tak pruritus, a vede ke zlepšení klinických příznaků pozorovaných u zánětu vnějšího zvukovodu.
Terbinafin je allylamin s výraznou fungicidní aktivitou. Selektivně inhibuje časnou syntézu ergosterolu, který je nezbytnou součástí membrány kvasinek a plísní včetně Malassezia pachydermatis (MIC90 2 ^g/ml).'Terbinafin má jiný způsob působení než azolová antimykotika, proto nedochází ke zkřížené rezistenci s azolovými antimykotiky.
Florfenikol je bakteriostatické antibiotikum, které působí inhibicí proteinové syntézy. Jeho spektrum působnosti zahrnuje grampozitivní a gramnegativní bakterie včetně Staphylococcus pseudintermedius (MIC90 8 ^g/ml).
Citlivost in vitro nemusí přímo korelovat s klinickou úspěšností vzhledem k vysokým antibakteriálním koncentracím dosažených ve zvukovodu a multifaktoriální povaze zánětu vnějšího zvukovodu.
5.2 Farmakokinetické údaje
Přípravek se rozpustí v ušním mazu a pomalu se eliminuje z ucha mechanickým způsobem. Systémová absorpce všech účinných látek byla stanovena ve studiích s opakovanými dávkami po aplikaci veterinárního léčivého přípravku do obou zvukovodů zdravých psů kříženců. K absorpci došlo primárně během prvních dvou až čtyř dnů po aplikaci, s nízkými koncentracemi léčivých látek v plazmě (1 až 42 ng/ml).
Rozsah perkutánní absorpce povrchově podávaných léčiv je určen mnoha faktory, včetně integrity epidermální bariéry. Zánět může zvýšit perkutánní absorpci veterinárních léčivých přípravků.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Butylhydroxytoluen (E321)
Hypromelosa
Lecithin
Kyselina olejová
Propylen-karbonát
Glyceroformal
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
Doba použitelnosti veterinárního léčivého přípravku v neporušeném obalu: 3 roky.
6.4 Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2 °C - 8 °C).
6.5 Druh a složení vnitřního obalu
Jednodávková vícevrstvá tuba z hliníku a polyethylenu, se špičkou z polypropylenového termoplastového elastomeru.
Kartonová krabička obsahující 2, 12, 20 nebo 40 tub (každá obsahuje 2,05 g).
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro zneškodňování nepoužitého veterinárního léčivého přípravku nebo odpadu, který pochází z tohoto přípravku
Všechen nepoužitý veterinární léčivý přípravek nebo odpad, který pochází z tohoto přípravku, musí být likvidován podle místních právních předpisů.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Elanco Europe Ltd.
Lilly House, Priestley Road
Basingstoke
RG24 9NL
SPOJENÉ KRÁLOVSTVÍ
8. REGISTRAČNÍ ČÍSLO(A)
EU/2/14/170/0001 (2 tuby) EU/2/14/170/0002 (12 tub) EU/2/14/170/0003 (20 tub) EU/2/14/170/0004 (40 tub)
9. DATUM REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum registrace: 31/07/2014
10. DATUM REVIZE TEXTU
<{MM/RRRR}>
< { DD/MM/RRRR} >
<{DD RRRR}>
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
ZÁKAZ PRODEJE, VÝDEJ A/NEBO POUŽITÍ Neuplatňuje se.
PŘÍLOHA II
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ
C. DEKLARACE HODNOT MRL
A. DRŽITEL POVOLENÍ K VÝROBĚ ODPOVĚDNÝ ZA UVOLNĚNÍ ŠARŽE
Jméno a adresa výrobce odpovědného za uvolnění šarže
Vericore Limited Kinnoull Road Kingsway West Dundee DD23XR Spojené Království
B. PODMÍNKY REGISTRACE NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE NEBO POUŽITÍ
Veterinární léčivý přípravek je vydáván pouze na předpis.
C. DEKLARACE HODNOT MRL
Neuplatňuje se.
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
PODROBNÉ ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartónová krabička
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
OSURNIA ušní gel pro psy
T erbinafin/florfenicol/betamethazon acetát
2. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
1 tuba: 10 mg terbinafinu, 10 mg florfenicolu, 1 mg betamethazoni acetátu
3. LÉKOVÁ FORMA
Ušní gel.
4. VELIKOST BALENÍ
2 tuby 12 tub 20 tub 40 tub

5. CÍLOVÝ DRUH ZVÍŘAT
Psi.
6. INDIKACE
7. ZPŮSOB A CESTA PODÁNÍ
Ušní podání.
Před použitím čtěte příbalovou informaci.
8. OCHRANNÁ LHŮTA
9. ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE (JSOU) NUTNÉ(Á)
Před použitím čtěte příbalovou informaci
10. DATUM EXSPIRACE
EXP:
11. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávejte v chladničce.
12. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Zneškodňování odpadu: čtěte příbalovou informaci.
13. OZNAČENÍ „POUZE PRO ZVÍŘATA“ A PODMÍNKY NEBO OMEZENÍ TÝKAJÍCÍ SE VÝDEJE A POUŽITÍ, POKUD JE JICH TŘEBA
Pouze pro zvířata. Veterinární léčivý přípravek je vydáván pouze na předpis.
14. OZNAČENÍ „UCHOVÁVAT MIMO DOSAH DĚTÍ“
Uchovávat mimo dosah dětí.
15. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
Elanco Europe Ltd.
Lilly House, Priestley Road Basingstoke
RG24 9NL
SPOJENÉ KRÁLOVSTVÍ
16. REGISTRAČNÍ ČÍSLO(A)
EU/2/14/170/0001 (2 tuby) EU/2/14/170/0002 (12 tub) EU/2/14/170/0003 (20 tub) EU/2/14/170/0004 (40 tub)
17. ČÍSLO ŠARŽE OD VÝROBCE
Šarže:
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU MALÉ VELIKOSTI Tuba
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
OSURNIA ušní gel pro psy
Terbinafinum, florfenicolum, betamethasoni acetas (Latin)
2. MNOŽSTVÍ LÉČIVÉ(ÝCH) LÁTKY(EK)
10 mg terbinafinu, 10 mg florfenicolu, 1 mg betamethazon acetátu
3. VYJÁDŘENÝ HMOTNOSTÍ, OBJEMEM NEBO POČTEM DÁVEK
1 dávka
4. CESTA(Y) PODÁNÍ
Ušní podání.
5. OCHRANNÁ LHŮTA
6. ČÍSLO ŠARŽE
Lot
7. DATUM EXSPIRACE
EXP
8. OZNAČENÍ „POUZE PRO ZVÍŘATA“
Pouze pro zvířata.
(uvádí se odkaz na piktogram psa v bodě 1)
OSURNIA ušní gel pro psy
1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÉ ŠARŽE, POKUD SE NESHODUJE
Držitel rozhodnutí o registraci:
Elanco Europe Ltd., Lilly House, Priestley Road, Basingstoke, RG24 9NL ,
SPOJENÉ KRÁLOVSTVÍ
Výrobce odpovědný za uvolnění šarže:
Vericore Limited, Kinnoull Road, Kingsway West, Dundee DD2 3XR, SPOJENÉ KRÁLOVSTVÍ
2. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU
OSURNIA ušní gel pro psy
Terbinafin/florfenicol/betametazon acetát (terbinafinum/florfenicolum/betamethasoni acetas)
3. OBSAH LÉČIVÝCH A OSTATNÍCH LÁTEK
Jedna tuba (1,2 g) obsahuje 10 mg terbinafinu, 10 mg florfenicolu a 1 mg betametazon acetátu Pomocná látka: 1 mg butylhydroxytoluenu (E321).
Krémově bílý až světle žlutý průsvitný gel.
4. INDIKACE
K léčbě akutního zánětu vnějšího zvukovodu a akutních exacerbací recidivujících zánětů vnějšího zvukovodu souvisejících se Staphylococcus pseudintermedius aMalasseziapachydermatis.
5. KONTRAINDIKACE
Nepoužívat v případě přecitlivělosti na léčivé látky, na ostatní kortikosteroidy nebo na některou z pomocných látek.
Nepoužívat, pokud je ušní bubínek perforovaný.
Nepoužívat u psů s generalizovanou demodikózou.
Nepoužívat u březích nebo chovných zvířat.
6. NEŽÁDOUCÍ ÚČINKY
U psů se zánětem vnějšího zvukovodu nebyly v terénních podmínkách pozorovány žádné nežádoucí účinky související s tímto veterinárním léčivým přípravkem.
Jestliže zaznamenáte jakékoliv závažné nežádoucí účinky či jiné reakce, které nejsou uvedeny v této příbalové informaci, oznamte to prosím vašemu veterinárnímu lékaři.
7. CÍLOVÝ DRUH ZVÍŘAT
Psi.
8. DÁVKOVÁNÍ PRO KAŽDÝ DRUH, CESTA(Y) A ZPŮSOB PODÁNÍ
Ušní podání. Podávejte jednu tubu na jedno infikované ucho. Opakujte aplikaci po 7 dnech. Maximální klinická odezva nemusí být viditelná až do 21 dní po druhé aplikaci.
1. Otevřete tubu otočením měkké špičky.
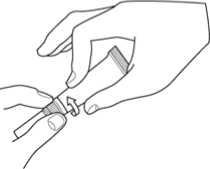
2. Zaveďte tuto pružnou měkkou špičku do zvukovodu.
3. Aplikuje přípravek do zvukovodu stlačením tuby mezi dvěma prsty.
4. Po aplikaci je možné dolní část ucha krátce a jemně promasírovat k usnadnění rovnoměrné distribuce veterinárního léčivého přípravku do zvukovodu.
9. POKYNY PRO SPRÁVNÉ PODÁNÍ
Před aplikací veterinárního léčivého přípravku je třeba důkladně vyšetřit vnější zvukovod, zda není perforovaný ušní bubínek.
Vyčistěte uši před úvodní aplikací přípravku. Čištění uší by se nemělo opakovat dříve než za 21 dní po druhé aplikaci. V klinických zkouškách se na čištění uší používal pouze fyziologický roztok.
Pokud je léčba tímto přípravkem přerušena, zvukovody by se měly vyčistit před zahájením léčby alternativním přípravkem.
10. OCHRANNÁ LHŮTA
Není určeno pro potravinová zvířata.
11. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ
Uchovávat mimo dosah dětí.
Uchovávejte v chladničce (2 °C - 8 °C).
Nepoužívejte tento veterinární léčivý přípravek po uplynutí doby použitelnosti uvedené na etiketě po „EXP“. Doba použitelnosti končí posledním dnem v uvedeném měsíci.
12. ZVLÁŠTNÍ UPOZORNĚNÍ
Zvláštní upozornění pro každý cílový druh:
Bakteriální a plísňový zánět vnějšího zvukovodu je často sekundárním projevem jiných onemocnění. Před zvážením antibakteriální léčbyby se měla stanovit příslušná diagnóza a léčba kauzativních potíží. Použití veterinárního léčivého přípravku, které je odlišné od pokynů uvedených v této příbalové informaci, může zvýšit prevalenci bakterií rezistentních na florfenikol a plísní rezistentních na terbinafin, a snížit účinnost léčby jinými antibiotiky a antimykotiky.
Je možné pozorovat přechodné zvlhčení vnitřní a vnější strany ušního boltce. Tento nález lze přisoudit přítomnosti přípravku a není důvodem ke klinickým obavám.
Zvláštní opatření pro použití u zvířat:
Bezpečnost přípravku nebyla stanovena u psů mladších než 2 měsíce nebo o hmotnosti nižší než 1,4 kg, během březosti a laktace nebo u chovných psů.
Ve studiích snášenlivosti (před a po stimulaci ACTH) bylo pozorováno po aplikaci přípravku snížení hladiny kortizolu, což naznačuje, že se betamethason vstřebává a vstupuje do systémové cirkulace. Toto zjištění nebylo v korelaci s patologickými, nebo klinickými příznaky a bylo reverzibilní.
Je třeba se vyhnout další léčbě kortikosteroidy.
Používejte obezřetně u psů s podezřením na onemocnění endokrinního systému, nebo pokud se takové onemocnění prokáže (tj. diabetes mellitus, hypotyreóza nebo hypertyreóza atd.).
V případě zánětu zvukovodu vyvolaného parazity aplikujte vhodnou akaricidní léčbu.
Pokud se objeví přecitlivělost na jakoukoliv složku, ucho by se mělo důkladně vypláchnout.
Vyjma fyziologického roztoku nebyla prokázána kompatibilita s jinými přípravky na čištění uší.
Předávkování (symptomy, první pomoc, antidota):
Dlouhodobé nebo intenzivní užívání tohoto přípravku může způsobit vznik puchýřků na epitelu bubínkové membrány nebo ulceraci sliznice výstelky dutiny středního ucha. Tyto nálezy neovlivňují sluch a jsou vratné.
Je známo, že dlouhodobé a intenzivní použití povrchově podávaných kortikosteroidů vyvolává systémové účinky, včetně suprese funkce nadledvinek.
Zvláštní opatření určené osobám, které podávají veterinární léčivý přípravek zvířatům:
V případě náhodného kontaktu s očima je důkladně vypláchněte vodou. V případě náhodného kontaktu s kůží důkladně opláchněte potřísněnou kůži vodou. V případě náhodného pozření vyhledejte ihned lékařskou pomoc a ukažte příbalovou informaci nebo etiketu praktickému lékaři.
13. ZVLÁŠTNÍ OPATŘENÍ PRO ZNEŠKODŇOVÁNÍ NEPOUŽITÝCH PŘÍPRAVKŮ NEBO ODPADU, POKUD JE JICH TŘEBA
Léčivé přípravky se nesmí likvidovat prostřednictvím odpadní vody či domovního odpadu.
O možnostech likvidace nepotřebných léčivých přípravků se poraďte s vaším veterinárním lékařem. Tato opatření napomáhají chránit životní prostředí.
14. DATUM POSLEDNÍ REVIZE PŘÍBALOVÉ INFORMACE
Podrobné informace o veterinárním léčivém přípravku jsou k dispozici na webové stránce Evropské lékové agentury http://www.ema.europa.eu/.
15. DALŠÍ INFORMACE
Tento přípravek je fixní kombinací tří léčivých látek: antibiotika, antimykotika a kortikosteroidu.
OSURNIA ušní gel pro psy je dostupný v následujících velikostech balení:
1 kartonová krabička obsahující 2 tuby.
1 kartonová krabička obsahující 12 tub.
1 kartonová krabička obsahující 20 tub.
1 kartonová krabička obsahující 40 tub.
Na trhu nemusí být všechny velikosti balení.
Pokud chcete získat informace o tomto veterinárním léčivém přípravku, kontaktujte prosím držitele rozhodnutí o registraci.
17